
 化學變化多姿多彩,美麗如花.如圖中甲、乙、丙、X分別是Fe2O3、C、CO、鹽酸中的某一種,甲、乙、丙均能與X發(fā)生化學反應(yīng),則X是Fe2O3其中一條化學方程式Fe2O3+6HCl═2FeCl3+3H2O.
化學變化多姿多彩,美麗如花.如圖中甲、乙、丙、X分別是Fe2O3、C、CO、鹽酸中的某一種,甲、乙、丙均能與X發(fā)生化學反應(yīng),則X是Fe2O3其中一條化學方程式Fe2O3+6HCl═2FeCl3+3H2O. 科目:初中化學 來源: 題型:選擇題
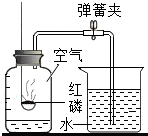 如圖所示裝置可用于測定空氣中氧氣的含量,實驗前在集氣瓶內(nèi)加入少量水,并做上記號,下列說法中不正確的是( )
如圖所示裝置可用于測定空氣中氧氣的含量,實驗前在集氣瓶內(nèi)加入少量水,并做上記號,下列說法中不正確的是( )| A. | 集氣瓶內(nèi)加入少量水可吸收產(chǎn)生的物質(zhì) | |
| B. | 該實驗所用紅磷的量不足可能造成氣體減少的體積小于$\frac{1}{5}$ | |
| C. | 實驗時,點燃的紅磷要立即伸入集氣瓶中,并塞緊橡皮塞 | |
| D. | 紅磷燃燒產(chǎn)生大量的白霧,火焰熄滅后立刻打開彈簧夾 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
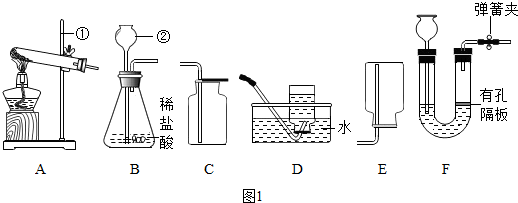
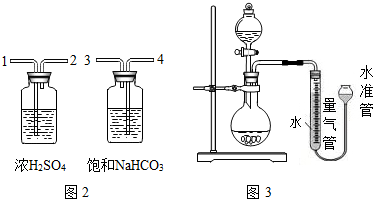
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
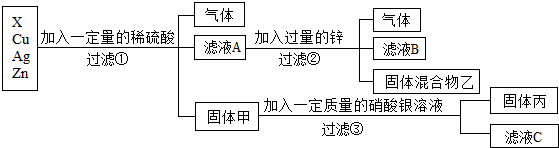
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com