
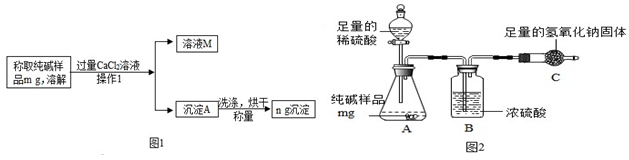
分析 【方案一】(1)根據操作中I加入過量氯化鈣的目的是把碳酸鈉充分反應,然后經過過濾操作把固體和液體分離進行分析;
(2)根據樣品中的氯化鈉和氯化鈣不反應,由于氯化鈣過量,因此碳酸鈉完全反應,且生成了氯化鈉,所以溶液M中含有的陽離子有鈉離子和鈣離子進行分析;
(3)根據若CaCl2不過量,則會有Na2CO3剩余,再加入CaCl2后若生成沉淀則說明不過量,如果無沉淀,則過量進行分析;
(4)根據若沉淀A沒有洗滌烘干,會導致計算出的碳酸鈉質量偏大;若沉淀A洗凈不干凈,則所得濾液中含有銀離子,可通過滴加AgNO3溶液觀察是否有沉淀的方法判斷進行分析;
(5)根據碳酸鈉和氯化鈣反應的化學方程式,結合生成的碳酸鈣的質量列比例方程計算即可;
【方案二】(1)根據碳酸鈉和稀硫酸反應生成硫酸鈉、水和二氧化碳進行分析;
(2)根據濃硫酸的吸水性和化學方程式的書寫方法進行分析;
(3)根據稱量C裝置在反應前后的質量,即可求得產生二氧化碳的質量進行分析;
(4)根據【方法二】中裝置內的殘留二氧化碳沒有被吸收,空氣中的二氧化碳和水蒸氣也會進入C裝置進行分析.
解答 解:方案一:(1)通過操作I得到了固體和液體,所以操作Ⅰ的名稱是過濾;
(2)樣品中的氯化鈉和氯化鈣不反應,由于氯化鈣過量,因此碳酸鈉完全反應,且生成了氯化鈉,所以溶液M中含有的陽離子有鈉離子和鈣離子;
(3)若氯化鈣有剩余,加入碳酸鈉溶液會生成碳酸鈣白色沉淀,若氯化鈣沒有剩余,加入碳酸鈉溶液無明顯變化,故選:B;
(4)若沉淀A沒有洗滌烘干,會導致計算出的碳酸鈉質量偏大,碳酸鈉的質量分數就偏大;判斷沉淀A洗凈的方法是:取最后一次洗滌所得濾液,滴加AgNO3溶液,若無白色沉淀,則洗滌干凈;
(5)設樣品中碳酸鈉的質量為x,則
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
x 10g
$\frac{106}{x}$=$\frac{100}{10g}$
x=10.6g
樣品中Na2CO3質量分數為:$\frac{10.6g}{12g}$×100%≈88.3%;
方案二:(1)碳酸鈉和稀硫酸反應生成硫酸鈉、水和二氧化碳,化學方程式為:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)濃硫酸具有吸水性,因此B裝置的作用是除去水蒸氣;二氧化碳和氫氧化鈉反應生成碳酸鈉和水,化學方程式為:CO2+2NaOH=Na2CO3+H2O;
(3)C裝置在反應前后的質量差,即是產生二氧化碳的質量;
(4)【方法二】中裝置內的殘留二氧化碳沒有被吸收,空氣中的二氧化碳和水蒸氣也會進入C裝置.
故答案為:方案一:(1)過濾;
(2)鈉離子和鈣離子;
(3)B;
(4)偏大,無;
(5)88.3%;
方案二:(1)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)除去水蒸氣,CO2+2NaOH=Na2CO3+H2O;
(3)C;
(4)裝置內的殘留二氧化碳沒有被吸收,空氣中的二氧化碳和水蒸氣也會進入C裝置.
點評 本題難度太大,考查了多方面的化學知識,要想做對此題必須知識全面,再加上足夠的細心和耐心才行.


 小天才課時作業系列答案
小天才課時作業系列答案 一課四練系列答案
一課四練系列答案 黃岡小狀元滿分沖刺微測驗系列答案
黃岡小狀元滿分沖刺微測驗系列答案 新輔教導學系列答案
新輔教導學系列答案科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 加碘鹽中的“碘”通常是指碘元素 | |
| B. | 單質和化合物屬于包含關系 | |
| C. | 質子數相同的粒子不一定是同種元素的原子 | |
| D. | 分解反應的反應物一定不是單質 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | ①③ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com