
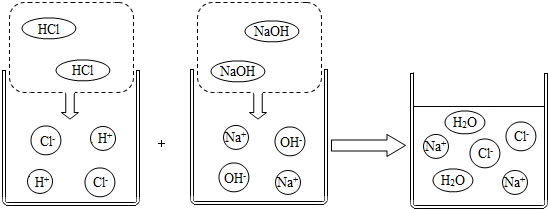
分析 (1)根據HCl、NaOH解離,發現物質解離規律,判斷H2SO4在水中會解離出的離子;
(2)對比反應前后的圖示,找出反應前后溶液中數目發生變化的粒子;
(3)利用復分解反應發生的條件,判斷“硫酸、氯化鋇、氫氧化鈉、碳酸鉀、氫氧化銅”五種物質的溶液兩兩混合,所能發生的反應;
(4)根據復分解反應實質就是離子之間生成水、沉淀、氣體的反應來分析.
解答 解:(1)由HCl在水中會解離出H+和Cl-,NaOH在水中會解離出Na+和OH-,可得知解離時原子團并不分開,因此H2SO4在水中會解離出氫離子和硫酸根離子,兩種離子的符號分別為H+、SO42-;故填:H+、SO42-;
(2)反應前H+、OH-在反應后不存在,而反應后出現了H2O,反應前后Na+和Cl-不變,所以反應前后溶液中數目發生變化的粒子是H+、OH-、H2O;故填:H+、OH-、H2O;
(3)硫酸與氯化鋇可產生硫酸鋇沉淀、與氫氧化鈉可形成水、與碳酸鉀可生成水與二氧化碳,氯化鋇與碳酸鈉可形成碳酸鋇沉淀,硫酸與氫氧化銅反應生成水,符合復分解反應產生水或氣體或沉淀的發生條件,而氯化鋇與氫氧化鈉、氫氧化鈉與碳酸鈉、氫氧化銅與氯化鋇、氫氧化鈉、碳酸鉀,因不能形成氣體、水或沉淀而不能發生復分解反應,因此“硫酸、氯化鋇、氫氧化鈉、碳酸鉀、氫氧化銅”五種物質的溶液兩兩混合,共能發生5個反應;故填:5;
(4)得出復分解反應發生條件的實質是:復分解反應的實質是離子交換的反應,只要反應物中某些離子濃度減小了(或不能大量共存),復分解反應就可以發生.故填:復分解反應的實質是離子交換的反應,只要反應物中某些離子濃度減小了(或不能大量共存),復分解反應就可以發生.
點評 在解該題時,首先要理解透復分解反應的條件是生成氣體、水或沉淀,然后就是整合題中有用的知識采用類比的思想解答.


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
 ,下列說法中錯誤的是( )
,下列說法中錯誤的是( )| A. | 該元素是一種非金屬元素 | B. | 該粒子有10個電子 | ||
| C. | 該粒子原子核內有11個質子 | D. | 該粒子是陽離子 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
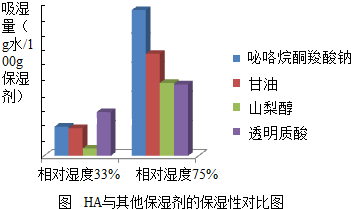 20世紀80年代以來,透明質酸以其優質的保濕、營養皮膚和防曬修復皮膚等特殊性能受到國際化妝品界的廣泛關注.透明質酸簡稱HA,又名玻璃酸或玻尿酸,化學式:(C14H21NO11)n,是大分子物質.據此回答問題:
20世紀80年代以來,透明質酸以其優質的保濕、營養皮膚和防曬修復皮膚等特殊性能受到國際化妝品界的廣泛關注.透明質酸簡稱HA,又名玻璃酸或玻尿酸,化學式:(C14H21NO11)n,是大分子物質.據此回答問題:| 樣品 | A280 | A260 | A280/A260 | PceK |
| 本產品HA | 0.077 | 0.094 | 0.82 | 1.866(204) |
| SH-HA(美國) | 0.140 | 0.162 | 0.86 | 1.940(205) |
| Healon(瑞德) | 0.069 | 0.081 | 0.85 | 1.581(204) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com