9.某化學課堂圍繞“酸堿中和反應”,將學生分成若干小組,在老師引導下開展探究活動.以下是教學片段,請你參與學習并幫助填寫空格(包括表中空格).
【演示實驗】將一定量的稀H
2SO
4加入到盛有NaOH溶液的小燒杯中.
【學生板演】該反應的化學方程式2NaOH+H
2SO
4═Na
2SO
4+2H
2O.
【提出問題】實驗中未觀察到明顯現象,部分同學產生了疑問:反應后溶液中溶質是什么呢?
【假設猜想】針對疑問,大家紛紛提出猜想.甲組同學的猜想如下:
猜想一:只有Na
2SO
4 猜想二:有Na
2SO
4和H
2SO
4猜想三:有Na
2SO
4和NaOH 猜想四:有Na
2SO
4、H
2SO
4和NaOH
乙組同學對以上猜想提出質疑,認為有一種猜想是不合理的.不合理的猜想是猜想四.不合理的理由是硫酸和氫氧化鈉不能共存.
【實驗探究】(1)丙組同學取燒杯中的溶液少量于試管中,滴加幾滴CuSO
4溶液,無明顯變化,溶液中一定沒有NaOH.
(2)為了驗證其余猜想,各學習小組利用燒杯中的溶液,并選用老師提供的pH試紙、銅片、BaCl
2溶液、Na
2CO
3溶液,進行如下三個方案的探究.
| 實驗方案 | 測溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 實驗操作 | 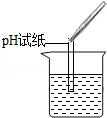 |  |  |
| 實驗現象 | 試紙變色,對比比色卡,pH<7 | | 產生白色沉淀 |
| 實驗結論 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【得出結論】通過探究,全班同學一致確定猜想二是正確的.
【評價反思】老師對同學們能用多種方法進行探究,并且得出正確結論給予肯定.同時指出
【實驗探究】(2)中存在兩處明顯錯誤,請大家反思.同學們經過反思發現了這兩處錯誤:
(1)實驗操作中的錯誤是把pH試紙伸入溶液中.
(2)實驗方案中也有一個是錯誤的,錯誤的原因是錯誤是:利用氯化鋇溶液檢驗硫酸;
錯誤原因是:即使溶液中不含有硫酸,硫酸鈉也能夠和氯化鋇反應生成白色沉淀硫酸鋇.
【拓展延伸】
(1)小燕同學在課后也做了該實驗,但是她在滴加稀硫酸的過程中發現溶液中有少量氣泡產生.這一“異常現象”激起了他們的探究欲望,通過實驗證明:該同學用的這瓶氫氧化鈉溶液已經部分變質.請用化學方程式表示其變質的原因:2NaOH+CO
2═Na
2CO
3+H
2O;產生氣泡的反應方程式為:Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑;若要除去溶液中變質生成的雜質,請簡要寫出你的實驗方案:向溶液中滴加氫氧化鈣溶液,邊滴加邊振蕩,直至不產生白色沉淀時停止滴加,過濾除去沉淀,得到氫氧化鈉溶液.
(2)在演示實驗中取10g氫氧化鈉溶液放入燒杯中,當溶液的pH為7時消耗了20g9.8%的稀硫酸,則該氫氧化鈉溶液的溶質質量分數為16%.