
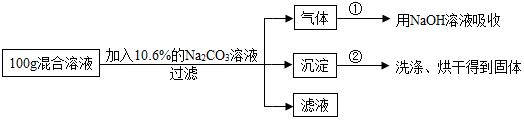
分析 (1)根據二氧化碳與氫氧化鈉的反應寫出反應的化學方程式;
(2)由題意可以知碳酸鈉與氯化鈣反應生成了碳酸鈣沉淀和氯化鈉,根據沉淀的質量可求出氯化鈣、碳酸鈉、氯化鈉的質量,據此可計算出混合溶液中CaCl2的質量分數;
(3)根據圖中數據可以知道生成二氧化碳的質量為4.4g,結合碳酸鈉和鹽酸反應的化學方程式可以求出碳酸鈉的質量、氯化鈉的質量,再根據溶質質量分數的計算公式計算出混合溶液與Na2CO3溶液恰好完全反應,經過濾后所得濾液中溶質的質量分數.
解答 【解答】解:(1)根據題意可知,混合液中的稀鹽酸與碳酸鈉反應生成的二氧化碳氣體與氫氧化鈉反應生成了碳酸鈉和水,反應的化學方程式是:CO2+2NaOH═Na2CO3+H2O.
(2)設混合溶液中CaCl2的質量為x、生成的氯化鈉的質量為y,與氯化鈣反應的碳酸鈉的質量為z
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100 117
x z 10g y
$\frac{111}{x}=\frac{106}{z}=\frac{100}{10g}=\frac{117}{y}$
解得:x=11.1g y=11.7g z=10.6g
∴混合溶液中CaCl2的質量分數為:$\frac{11.1g}{100g}$×100%=11.1%;
(3)氫氧化鈉溶液增加的質量即為碳酸鈉和鹽酸反應生成二氧化碳的質量,即為4.4g,
設與鹽酸反應的碳酸鈉的質量為m,生成的氯化鈉的質量為n
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
m n 4.4g
$\frac{117}{44}=\frac{z}{4.4g}$ 解得m=10.6g n=11.7g
反應的碳酸鈉的質量為:$\frac{10.6g+10.6g}{10.6%}$=200g
經過濾后所得濾液中溶質的質量分數為:$\frac{11.7g+11.7g}{100g+200g-10g-4.4g}×100%$≈8.2%
故答案為:(1)CO2+2NaOH═Na2CO3+H2O;(2)(2)混合溶液中CaCl2的質量分數為11.1%;(3)實驗中混合溶液與Na2CO3溶液恰好完全反應,經過濾后所得濾液中溶質的質量分數為8.2%
點評 要解答好這類題目,首先,要理解和熟記根據化學反應方程式的計算步驟和格式,以及與之相關的知識等.然后,根據所給的問題情景,結合反應流程,物質間反應的方程式,按照題目要求進行認真地解答即可.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:選擇題
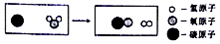
| A. | 生成的兩種物質都屬于單質 | B. | 生成物的分子個數比為1:1 | ||
| C. | 反應前后元素的化合價不變 | D. | 該反應不屬于基本反應類型 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
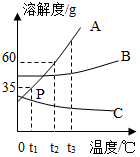 A、B、C三種物質的溶解度曲線如圖所示,請回答:
A、B、C三種物質的溶解度曲線如圖所示,請回答:查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:計算題
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
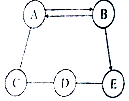 A、B、C、D、E為初中化學常見的五種物質,它們之間存在如圖所示的關系(“→”表示物質經一步反應可轉化為另一種物質,“-”表示相連兩物質能發生化學反應,部分反應物、生成物及反應條件已略去),請回答下列問題:
A、B、C、D、E為初中化學常見的五種物質,它們之間存在如圖所示的關系(“→”表示物質經一步反應可轉化為另一種物質,“-”表示相連兩物質能發生化學反應,部分反應物、生成物及反應條件已略去),請回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
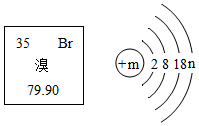 溴元素在元素周期表中的信息與溴原子結構示意圖如圖所示,下列說法正確的是( )
溴元素在元素周期表中的信息與溴原子結構示意圖如圖所示,下列說法正確的是( )| A. | 溴相對原子質量為79.90g | |
| B. | 溴原子質量由構成其原子的質子和電子決定 | |
| C. | 溴元素屬于金屬元素 | |
| D. | m=35、n=7 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | NaOH、Na2CO3、NaCl | B. | KNO3、NaCl、FeCl2 | ||
| C. | HCl、NaOH、NaCl | D. | Na2CO3、Ca(OH)2、NaCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com