
題目列表(包括答案和解析)
15.(1999年全國,14)氫鎳電池是近年開發出來的可充電電池,它可以取代會產生鎘污染的鎘鎳電池。氫鎳電池的總反應式是 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2。根據此反應式判斷,下列敘述中正確的是( )
Ni(OH)2。根據此反應式判斷,下列敘述中正確的是( )
A.電池放電時,電池負極周圍溶液的pH不斷增大 B.電池放電時,鎳元素被氧化
C.電池充電時,氫元素被還原 D.電池放電時,H2是負極
解析:放電時,H2做原電池負極被氧化為H+,其周圍的pH減小。充電時,H2做電解池的陰極,氫被還原為H2。
14.(1998年全國,22)將質量分數為0.052(5.2%)的NaOH溶液1 L(密度為1.06 g·cm-3)用鉑電極電解,當溶液中NaOH的質量分數改變了0.010(1.0%)時停止電解,則此時溶液中應符合的關系是( )
|
|
NaOH的質量分數 |
陽極析出物的質量/g |
陰極析出物的質量/g |
|
A |
0.062(6.2%) |
19 |
152 |
|
B |
0.062(6.2%) |
152 |
19 |
|
C |
0.042(4.2%) |
1.2 |
9.4 |
|
D |
0.042(4.2%) |
9.4 |
1.2 |
解析:電解NaOH溶液時電極反應為:
陽極:4OH--4e-====2H2O+O2↑
陰極:4H++4e-====2H2↑,即電解水。
由此可知電解后NaOH濃度增大,陽極產物(O2)質量大于陰極產物(H2)質量。
13.(1998年全國,10)下列關于銅電極的敘述正確的是( )
A.銅鋅原電池中銅是正極 B.用電解法精煉粗銅時粗銅作陰極
C.在鍍件上電鍍銅時可用金屬銅作陽極 D.電解稀硫酸制H2、O2時銅作陽極
解析:由于二者都是一元的,故可完全反應生成強堿弱酸鹽MA,A-水解顯堿性,故C正確;溶液呈電中性,故D正確。
12.(1998年上海,31)氯堿廠電解飽和食鹽水制取NaOH的工藝流程示意圖
14-4如下
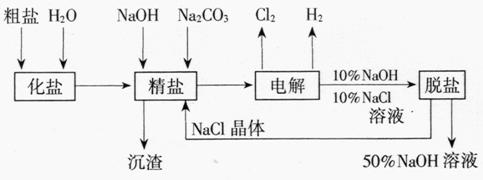
圖14-4
依據上圖,完成下列填空:
(1)在電解過程中,與電源正極相連的電極上所發生反應的化學方程式為 ,與電源負極相連的電極附近,溶液pH (選填“不變”“升高”或“下降”)。
(2)工業食鹽含Ca2+、Mg2+等雜質。精制過程發生反應的離子方程式為
、 。
(3)如果粗鹽中SO2-4含量較高,必須添加鋇試劑除去SO ,該鋇試劑可以
,該鋇試劑可以
是 (選填a,b,c多選扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)為有效除去Ca2+、Mg2+、SO ,加入試劑的合理順序為
(選填a、b、c多選扣分)。
,加入試劑的合理順序為
(選填a、b、c多選扣分)。
a.先加NaOH,后加Na2CO3,再加鋇試劑
b.先加NaOH,后加鋇試劑,再加Na2CO3
c.先加鋇試劑,后加NaOH,再加Na2CO3
(5)脫鹽工序中利用NaOH和NaCl在溶解度上的差異,通過 、冷卻、 (填寫操作名稱)除去NaCl
(6)在隔膜法電解食鹽水時,電解槽分隔為陽極區和陰極區,防止Cl2與NaOH反應;采用無隔膜電解冷的食鹽水時,Cl2與NaOH充分接觸,產物僅是NaClO和H2,相應的化學方程式為 。
解析:(1)與電源負極相連的電極,其反應為:2H++2e-===H2↑,促使H2O===H++
OH-向右移動,產生大量OH-,pH升高。
(3)溶液中已有OH-、Cl-,如果加入Ba(NO3)2,即摻入了新的雜質NO-3離子。
(4)欲有效除去三種離子,所加的三種試劑應過量,過量的Ba2+必須用CO2-3除去,所以加鋇試劑必須在加Na2CO3之前。
答案:(1)2Cl--2e-====Cl2;升高
(2)Ca2++CO =====CaCO3↓
=====CaCO3↓
Mg2++2OH-====Mg(OH)2↓
(3)a、c (4)b、c (5)蒸發;過濾
(6)NaCl+H2O=====NaClO+H2↑
或2NaCl+2H2O=======H2↑+Cl2↑+2NaOH
Cl2+2NaOH====NaCl+NaClO+H2O
11.(1998年上海,10)以下現象與電化腐蝕無關的是( )
A.黃銅(銅鋅合金)制作的銅鑼不易產生銅綠
B.生鐵比軟鐵芯(幾乎是純鐵)容易生銹
C.鐵質器件附有銅質配件,在接觸處易生鐵銹
D.銀制獎牌久置后表面變暗
解析:本題主要要求考生掌握形成原電池的條件、正負極的判斷等知識。答案:D
10.(1997年全國,5)鋼鐵發生吸氧腐蝕時,正極上發生的電極反應是( )
A.2H++2e-====H2 B.Fe2++2e-====Fe
C.2H2O+O2+4e-====4OH- D.Fe3++e-====Fe2+
答案:C
9.(1996年全國,21)實驗室用鉛蓄電池作電源電解飽和食鹽水制取氯氣,已知鉛蓄電池放電時發生如下反應:負極Pb+SO ====PbSO4+2e-,正極PbO2+4H++SO
====PbSO4+2e-,正極PbO2+4H++SO +2e-====PbSO4+2H2O今若制得Cl2 0.050mol,這時電池內消耗的H2SO4的物質的量至少是( )
+2e-====PbSO4+2H2O今若制得Cl2 0.050mol,這時電池內消耗的H2SO4的物質的量至少是( )
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
解析:該題只要明確原電池和電解池原理,抓住轉移電子守恒即可。由2Cl--2e-=Cl2,可知制0.05 mol Cl2轉移0.10 mol電子,再由鉛蓄電池總反應:
Pb+PbO2+4H++2SO ======2PbSO4+2H2O 可看出每轉移2 mol e-消耗2 mol H2SO4,現轉移0.10 mol電子,將耗0.10 mol硫酸。
======2PbSO4+2H2O 可看出每轉移2 mol e-消耗2 mol H2SO4,現轉移0.10 mol電子,將耗0.10 mol硫酸。
8.(1995年全國,17)將分別盛有熔融的氯化鉀、氯化鎂、氧化鋁的三個電解槽串聯,在一定條件下通電一段時間后,析出鉀、鎂、鋁的物質的量之比為( )
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
解析:三個電解槽通過的電子數相等,設都通過6 mol電子(此為參照數法),則析出金屬鉀、鎂、鋁的物質的量分別為6 mol、3 mol、2 mol,所以比為6∶3∶2。
8.(1995年上海,27)G、Q、X、Y、Z均為氯的含氧化合物,我們不了解它們的化學式,但知道它們在一定條件下具有如下的轉換關系(未配平):
(1)G Q+NaCl
(2)Q+H2O
Q+NaCl
(2)Q+H2O X+H2
X+H2
(3)Y+NaOH G+Q+H2O (4)Z+NaOH
G+Q+H2O (4)Z+NaOH Q+X+H2O
Q+X+H2O
這五種化合物中氯的化合價由低到高的順序為( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
解析:此題要求掌握①歧化反應原理即由中間價生成相對較高價態和較低的價態,由此可知(3)中Y的價態介于Q、G之間;由(4)知Z的化合價介于Q、X之間;②Q+H2O X+H2,其中H2由2H+
X+H2,其中H2由2H+ H2得之,而X則一定由Q失電子化合價升高得之,即化合價X>Q,聯系(4)可知Q<Z<X;由(1)NaCl中Cl-為氯的最低價,可知Q價>G價,聯系(3)可知G<Y<Q,故選C。
H2得之,而X則一定由Q失電子化合價升高得之,即化合價X>Q,聯系(4)可知Q<Z<X;由(1)NaCl中Cl-為氯的最低價,可知Q價>G價,聯系(3)可知G<Y<Q,故選C。
8.(1994年全國,22)銀鋅電池廣泛用作各種電子儀器的電源,它的充電和放電
過程可以表示為2Ag+Zn(OH)2 Ag2O+Zn+H2O,在此電池放電時,負極上發生反應的物質是( )
Ag2O+Zn+H2O,在此電池放電時,負極上發生反應的物質是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
解析:根據方程式,放電時反應為:
?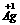 2O+
2O+ +H2O 2
+H2O 2 +
+ (OH)2原電池中失去電子的物質是負極,所以選D。
(OH)2原電池中失去電子的物質是負極,所以選D。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com