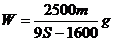2007-2008學年度江蘇省秋實學苑期中考試
化學試卷
本試卷分選擇題和非選擇題兩部分,滿分120分。考試時間100分鐘。
可能用到的相對原子質量:H -1 C-
12 O-16 N -14 Na-23 Cl 35.5 K-39 Ca-40 Ba 137
I卷選擇題(共57分)
一、選擇題(本題包括10小題,每小題3分,共30分,每小題只有一個選項符合題意)
1.自然界里常見金屬元素存在最多的是Al,其次是鐵,銅的含量較少。然而人類冶煉金屬獲得成功最早的反而是含量少的銅,含量最多的鋁最遲冶煉出來。金屬是當今社會最不可缺少的材料之一。下列有關金屬的說法不正確的是 ( )
A.銅比鋁先獲得成功冶煉原因是,銅礦較易還原,鋁礦很難還原。
B.目前已制得的純金屬只有90多種,但制得的合金已達幾千種,大量使用的不是純金屬而是它們的合金。
C.生鐵易生銹不耐蝕,但純鐵具有耐蝕性,所以不銹鋼應是最純的鐵。
D.廢棄鋁質包裝既浪費金屬材料又造成環(huán)境污染
試題詳情
2.利用新技術能將不銹鋼加工成柔軟的金屬絲,它可以和棉纖維一起編織成為防輻射的勞防服裝,這是利用了金屬的
A.耐腐蝕性 B.還原牲 C.熱傳導性 D.延展性
試題詳情
3.環(huán)境污染問題越來越受到人們的關注,造成環(huán)境污染的主要原因大多是由于人類生產(chǎn)活動中過度排放有關物質引起的。下列環(huán)境問題與所對應的物質不相關的是 ( )
A.溫室效應――二氧化碳 B.光化學污染――二氧化氮
C.酸雨――二氧化碳 D.臭氧層破壞――氟氯烴
試題詳情
4.小華家中有如下生活用品:碘酒、食鹽、食醋、84消毒液(內含NaClO),小華利用上述用品不能完成的任務是
A.檢驗買來的奶粉中是否加有淀粉 B.檢驗自來水中是否含有Cl-
C.除去保溫瓶中的水垢
D.洗去白色衣服上的番茄汁
試題詳情
5.“空對空”響尾蛇導彈頭部的“紅外眼睛”,能分辯出0.001℃的溫差變化,它是由熱敏陶瓷材料和熱釋電陶瓷材料做成的。下列敘述中不正確的是 ( )
A.“紅外眼睛”對熱非常敏
B.“紅外眼睛”的熱目標是敵機發(fā)動機或尾部噴口高溫區(qū)
C.“紅外眼睛”的電阻值隨溫度明顯變化
D.“紅外眼睛”的工作原理與人眼相同
試題詳情
6.通過控制或改變反應條件可以加快、減緩甚至阻止反應的進行,使化學反應有利于人類的生存和提高生活質量。下列各圖所示的措施中,能加快化學反應速率的是
試題詳情
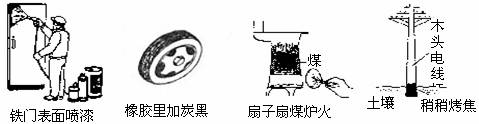
A
B
C
D
試題詳情
7.下面有關硅的敘述中,正確的是( )
A.光導纖維是以硅酸鹽為主要原料制成的
B.硅是構成礦物和巖石的主要元素,硅在地殼中的含量在所有的元素中居第一位
C.硅的化學性質不活潑,在自然界中可以以游離態(tài)存在
D.硅在電子工業(yè)中,是最重要的半導體材料
試題詳情
8.某工廠用CaSO4、NH3、H2O、CO2制備(NH4)2SO4,其工藝流程如下:
試題詳情

下列推斷不合理的是
( )
A.直接蒸干濾液得到純凈的(NH4)2SO4
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循環(huán)使用
D.往甲中通CO2有利于(NH4)2SO4生成
試題詳情
9.澤維爾用飛秒(時間單位:1飛秒=10-15秒)激光技術研究了氰化碘(ICN)的分解反應ICN→I++CN-,發(fā)現(xiàn)該變化可在200飛秒內完成。已知(CN)2和鹵素的性質相似。以下有關ICN的敘述中正確的是( )
A.ICN不能和NaOH溶液反應 B.ICN是一種共價化合物
C.將ICN加入到氯水中可生成I2
D.ICN的晶體是離子晶體
試題詳情
10.一些鹽的結晶水合物,在溫度不太高時就有熔化現(xiàn)象,即熔溶于自身的結晶水中,又同時吸收熱量。它們在塑料袋中經(jīng)日曬就熔化,又在日后緩慢凝結而釋放熱量。故可用于調節(jié)室內的溫度,或作夏日防暑用枕墊或座墊,這些物質可稱之為潛熱材料。現(xiàn)有幾種鹽的結晶水合物有關數(shù)據(jù)如下:
試題詳情
試題詳情
①
試題詳情
②
試題詳情
③
試題詳情
④
熔點(℃)
40~50
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
100.1
根據(jù)上述數(shù)據(jù),實際應用時最常采用的(由來源和成本考慮)應該是
A.① B.② C.③ D.④
試題詳情
二、選擇題(本題共9小題,每小題3分,共27分。每小題有一或兩個選項符合題意)
11.蛇紋石由MgO、A12O3、SiO2、Fe2O3組成。現(xiàn)取一份蛇紋石試樣進行實驗,首先將其溶于過量的鹽酸,過濾后,在所得的沉淀X和溶液Y中分別加入NaOH溶液至過量。下列敘述不正確的是
A.沉淀X的成分是SiO2
B.將蛇紋石試樣直接溶于過量的NaOH溶液后過濾,可得到紅色顏料Fe2O3,
C.在溶液Y中加入過量的NaOH溶液,過濾得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的陽離子主要是Mg2+、Al3+、Fe3+、H+
試題詳情
12.下列離子方程式,正確的是
( )
A.在溶液中亞硫酸氫銨與等物質的量氫氧化鈉混合
試題詳情
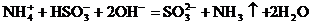
B.碳酸鈉溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅與燒堿溶液反應:SiO2 +2OH- === SiO32-+H2O
D.硅酸與燒堿溶液中和:H2SiO3 +2OH- === SiO32-+2H2O
試題詳情
13.某同學用一小塊鋁片和鹽酸反應制取H2,實驗現(xiàn)象如下表:
時間
1 min
2 min
5 min
15 min
20 min
現(xiàn)象
少量氣泡
較多氣泡
大量氣泡
反應劇烈
鋁片耗盡
反應1~15min內,鋁與鹽酸的反應速率變化的可能原因是
( )
A.該反應是放熱反應,溫度升高 B.反應過程中鹽酸的濃度增大
C.隨著反應的進行,鋁片表面積變小 D.Cl-離子是該反應的催化劑
試題詳情
14.用NA表示阿伏加德羅常數(shù)的值,下列說法中正確的是( )
試題詳情
A.0.36 g水中所含中子數(shù)一定為0.2 NA
試題詳情
B.4.48 L N2與CO的混合物所含分子數(shù)一定為0.2 NA
試題詳情
C.6.4 gS6與S8的混合物中所含S原子數(shù)一定為0.2 NA
試題詳情
D.標準狀況下,2.24 L氧氣所含原子數(shù)一定為0.2 NA
試題詳情
15.實驗室需配制一種僅含四種離子(不包括水電離出的離子)的無色混合溶液,且在混合溶液中四種離子的物質的量濃度均為lmol?L-1。下面四個選項中能達到此目的的是( )
A.NH4+、Na+、NO3-、Cl-
B.Cu2+、K+、SO42―、NO3―
C.H+、K+、HCO3-、Cl― D.Mg2+、Na+、Cl―、SO42―
試題詳情
16.已知酸性條件下有如下反應:2Cu+=Cu2++Cu。由于反應溫度不同,用氫氣還原氧化銅時,可能產(chǎn)生Cu或Cu2O,兩者都是紅色固體。一同學對某次用氫氣還原氧化銅實驗所得的紅色固體產(chǎn)物作了驗證,實驗操作和實驗現(xiàn)象記錄如下 ( )
加入試劑
稀硫酸
濃硫酸、加熱
稀硝酸
濃硝酸
實驗現(xiàn)象
紅色固體
和藍色溶液
無色氣體
無色氣體
和藍色溶液
紅棕色氣體
和綠色溶液
由此推出本次氫氣還原氧化銅實驗的產(chǎn)物是
A.Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
試題詳情
17.t℃時CuSO4的溶解度是S g,其飽和溶液密度d g.cm-3、物質的量濃度為c mol.L-1。向足量飽和溶液中加入m g無水CuSO4或蒸發(fā)掉n g水后恢復t℃,均能獲得W g膽礬晶體,下列關系式正確的是( )
試題詳情
A.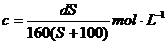 B.
B.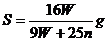
試題詳情
C.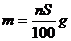 D.
D.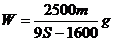
試題詳情
18.有10
g不純CaCO3樣品與足量鹽酸作用后生成4.44 g CO2,且溶液中殘留難溶物質。則對于此樣品中是否存在①MgCO3
②K2CO3 ③SiO2雜質的判斷正確的是( )
A.肯定含①③,不含② B.肯定含①③,可能含②
C.肯定含②③,不含① D.肯定含②③,可能含①
試題詳情
19.某學生用NaHCO3,和KHCO3,組成的某混合物進行實驗,測得如下數(shù)據(jù)(鹽酸的物質的量濃度相等)
50mL 鹽酸
50mL 鹽酸
50mL 鹽酸
m(混合物)
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
A.鹽酸的物質的量濃度為3.0mol?L
B.根據(jù)表中數(shù)據(jù)不能計算出混合物中NaHCO3的質量分數(shù)
試題詳情
試題詳情
D.15.7g混合物恰好與鹽酸完全反應
|
試題詳情
20.(6分)某學生為了使過濾操作能自動添加液體,設計了“自動加液過濾器”,如圖所示。在倒置的燒瓶中盛放待過濾的液體,液體從“液體流出管”流入漏斗。為使液體順利流下,還需插入“空氣導入管”與大氣相通。 試題詳情
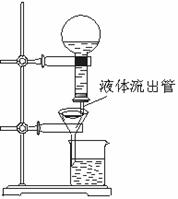
(1)“空氣導入管”下口應在____ ,上口應在_______ 。 A.濾紙邊沿下方 B.濾紙邊沿上方 C.待過濾液液面上 D.待過濾液中 E.A和B項均可 F.C和D項均可 (2)試簡要說明自動加液過濾的原理。__________________________ 試題詳情
21.(6分)某研究小組擬用定量的方法測量Al和Fe分別與酸反應的快慢,設計了下圖1所示的裝置。 試題詳情
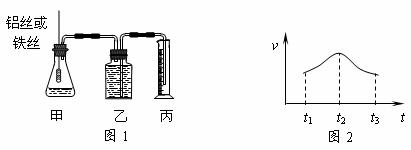
⑴檢查圖1裝置氣密性的方法是______________________________________。 ⑵若要比較產(chǎn)生氣體的快慢,可以測量相同時間內產(chǎn)生氣體的體積,也可以測量___________________________________。 ⑶實驗測得鋁絲產(chǎn)生氣體的速率(v)與時間(t)的關系如上圖2所示,則t1~t2時間內反應速率逐漸加快的主要原因是_______________________________________。 四題(共2小題,23分) 試題詳情
22.(11分)、某校高一化學研究性學習小組對日常生活中的氯氣用途進行了調查,了解到氯氣可廣泛地應用于衣物的漂白、水體的殺菌和消毒等。 (1)氯氣可以用于漂白、消毒的原因是因為能與水作用形成具有
性的次氯酸,相關反應的離子方程式為
; 試題詳情
(2)在調查某室外游泳池夏季池水消毒情況時,小組成員了解到,該游泳池每周一上午8∶00換水,然后通入氯氣消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0mg/L之間時,效果最好。下圖是該小組測定的每天19∶00時泳池中水的氯含量,哪幾天使用泳池不安全 ; 試題詳情
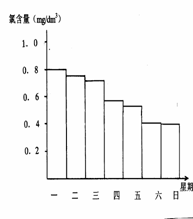
(3)你認為哪幾天的天氣炎熱、陽光強烈 ,說出一種理由是 ; (4)在對泳池水中通入氯氣消毒時,當發(fā)生氯氣泄漏時,應立即關閉氯氣罐,還應采取下列自救方法
。(選填序號) A、用濕潤的毛巾捂住口鼻跑向低處 B、用浸濕小蘇打或肥皂水的毛巾捂住口鼻跑向高處 C、用浸濕濃氨水的毛巾捂住口鼻匍匐跑至安全處 D、用浸濕食鹽水的毛巾捂住口鼻順風跑至安全處 (5)小型泳池通常使用漂白液(NaClO溶液)而非氯氣來消毒池水,試舉出使用漂白液而非氯氣的一項理由
; (6)請再寫出你能知道的能用于飲用水消毒的消毒劑(至少寫三種,否則不得分)
請在你書寫的藥品中選擇一種你認為最好的帶上飛機,并說明它的原因。 選擇
原因
試題詳情
23.(12分)胃酸過多是常見的胃病。下面是甲、乙兩種常見胃藥的說明摘要。 甲:①白色結晶狀粉末,受熱可緩緩分解;②能溶于水,水溶液呈弱堿性;灼燒時火焰為黃色;③遇酸及酸性藥物則產(chǎn)生二氧化碳;④患者服用過量,可能引起胃脹氣,甚至有引起胃潰瘍穿孔的危險。 乙:①與胃酸是中和作用緩慢而持久,可維持3~4小時; ②凝膠本身覆蓋于潰瘍面上,具有保護作用;③可溶于稀酸或氫氧化鈉溶液中。 (1)請你推測,甲中含有的主要化學成份是 (填化學式);乙中含有的主要化學成份是 (填化學式)。 (2)試寫出甲中含有的主要化學成份引起胃脹氣反應的離子方程式:
。 (3)三硅酸鎂Mg2Si3O8?nH2O也是常用胃藥,被用來治療胃潰瘍,是因為該物質不溶于水,服用后中和胃酸作用持久。把三硅酸鎂改寫成氧化物形式為:_____ ____。 寫出它中和胃酸(胃酸的主要成分是HCl)的化學方程式_____________________。 (4)目前一種新型抗酸劑能迅速改善和緩解胃酸過多的癥狀,它主要由碳酸鎂、氫氧化鎂和氫氧化鋁組成(說明:Mg(OH)2在高溫下分解為MgO)。現(xiàn)按如下步驟測定藥劑中三種主要成分的配比: 試題詳情
①取藥劑樣品,研磨后,加入50mL3.6 mol?L―1鹽酸,正好完全反應并收集得到標準狀況下224mL氣體 ②過濾,棄去其中不溶性物質(其余成分不參與反應) 試題詳情
③取②中濾液,加入足量的NaOH溶液后,過濾、洗滌、灼燒,所得固體2.4g。 則該藥劑中三種主要成分的物質的量之比為n(MgCO3):n(Mg(OH)2):n(Al(OH)3)=_________。 五題(共2小題,25分) 試題詳情
24.(14分)某研究性學習小組探究下列化學反應的特征: (I)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O (Ⅱ)FeS+HNO3→Fe(NO3)3+Fe2(SO4)3+NO2↑+N2O4↑+NO↑+H2O (Ⅲ)CuSO4→CuO+SO3↑+SO2↑+O2↑ (Ⅳ)CO2+KOH→KHCO3+K2CO3+H2O ⑴大多數(shù)化學反應中物質的化學計量數(shù)之比是固定的,但上述化學反應的化學計量數(shù)之比是不確定的,即物質的化學計量數(shù)有多組。根據(jù)上述實例,請用一句話歸納化學計量數(shù)有多組的化學反應的特點: 。 ⑵反應(Ⅱ)中還原產(chǎn)物是 ,若其物質的量之比確定,該反應的化學計量數(shù)也隨之確定。 ⑶有人認為反應(Ⅲ)是兩個反應式加合的結果,請分析它是哪兩個化學反應加合而成的:______________________________________、_____________________________。 在反應(Ⅲ)中,根據(jù)電子轉移守恒,物質_______和 的物質的量之比是固定的。 ⑷若將16gCuSO4固體粉末按反應(Ⅲ)完全分解,最終氣體產(chǎn)物的物質的量的取值范圍是: 。 ⑸若反應(Ⅳ)中KHCO3、K2CO3的化學計量數(shù)分別為a、b,則用a、b表示該反應的化學計量數(shù)的化學方程式是 。 試題詳情
25.(11分)下圖中所有物質均為中學化學常見物質,F(xiàn)、H是氣體單質,Z是固體金屬單質,Y中陽離子與陰離子個數(shù)比為2:1 ,化合物X、Y、A、D、E、G的焰色反應為黃色,I是白色沉淀。 試題詳情
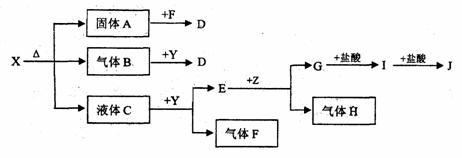
(1)寫出X、E、I的化學式。X
E
I
。 (2)寫出Y的電子式
。 (3)關于Y的說法正確的是
。 A.Y是氧化物
B.Y是過氧化物 C.Y是含有非極性鍵的離子化合物 D.Y是堿性氧化物 (4)寫出B和Y反應的化學方程式:
。 (5)X和G的溶液能反應嗎?如能反應,寫出反應的離子方程式;如不能反應,請說明理由:
六題(共1小題,9分) 試題詳情
26.(9分)在一定量的石灰乳中通入一定量的氯氣,二者恰好完全反應(發(fā)生反應的反應均為放熱反應)。生成物中有三種含氯元素的離子,其中兩種離子的物質的量(n)與反應時間(t)的曲線如圖所示。已知,生成C1O3-離子的反應為: 6Ca(OH)2+6C12
5CaC12+Ca(C1O3)2+6H2O。 試題詳情
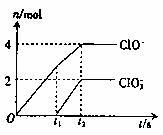
試回答: (1)t2時,Ca(C1O)2與Ca(C1O3)2的物質的量之和為
mol,該石灰乳中含有的Ca(OH)2的質量是
g。 (2)據(jù)分析,生成Ca(C1O3)2的反應是由溫度升高引起的,通過氯氣的速度不同,C1O-和C1O3-的比例也不同。若在原石灰乳中通入氯氣的速度加快,則反應后 試題詳情
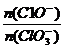 將 2(填“>”“<”或“=”);若 將 2(填“>”“<”或“=”);若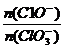 =a,則n(C1-)= =a,則n(C1-)=
mol(用含a的代數(shù)式來表示)。 附加題:本題僅供有有興趣的同學參考,不計入本次考試的成績中。 試題詳情
27.(14分)紅礬鈉(重鉻酸鈉:Na2Cr2O7?2H2O)是重要的基本化工原料,在印染工業(yè)、電鍍工業(yè)和皮革工業(yè)中作助劑,在化學工業(yè)和制藥工業(yè)中也用作氧化劑,應用領域十分廣泛。 (1)實驗室中紅礬鈉可用鉻鐵礦(主要成分:FeO?Cr2O3)利用以下過程來制取。 試題詳情
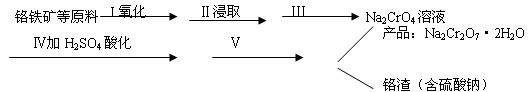
①步驟I中反應的化學方程式為: 試題詳情
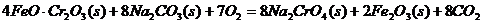 該反應的化學平衡常數(shù)的表達式為
,在常溫下該反應速度極慢,下列措施中能使反應速率增大的是
。 該反應的化學平衡常數(shù)的表達式為
,在常溫下該反應速度極慢,下列措施中能使反應速率增大的是
。
A.升高溫度
B.通入過量的空氣
C.將原料粉碎 D.增加純堿的用量 ②步驟Ⅱ中所得溶液顯堿性,其中除含有Na2CrO4外還含有鋁、硅元素的化合物,它們的化學式可能是
、
。 ③步驟Ⅲ需將溶液的pH調至7~8并煮沸,其目的是
。 ④步驟Ⅳ中發(fā)生反應的離子方程式為:
。 (2)將紅礬鈉與KCl固體1:2(物質的量比)混合溶于水后經(jīng)適當操作可得到K2Cr2O7晶體。請?zhí)顚懕碇锌崭瘛M瓿缮鲜鲞^程。 序號 實驗步驟 簡述實驗操作(不必敘述如何組裝實驗裝置) ① 溶解 將混合物放入燒杯中,加水,充分攪拌直到固體不再溶解。 ② ③ ④ ⑤ 過濾、干燥 得到K2Cr2O7晶體 試題詳情
主站蜘蛛池模板:
欧美一区二区三区爽大粗免费
|
国产精品第一国产精品
|
亚洲一区二区三区四区五区午夜
|
成人国产精品久久久
|
在线成人国产
|
亚洲视频在线播放
|
四虎影|
神马久久久久久久
|
久草在线在线精品观看
|
亚洲污视频
|
国产日韩欧美视频
|
欧美自拍视频
|
99国产视频
|
国产欧美一区二区精品性色
|
黄色片在线免费看
|
欧美日本在线观看
|
作爱视频免费看
|
国产精品视频一区二区免费不卡
|
99热影院|
欧美日韩卡一卡二
|
日韩在线视频观看
|
三级在线视频
|
国产精品二区三区
|
日本激情视频在线观看
|
综合久久综合久久
|
青青久久久
|
国产99页|
亚洲国产精品一区二区久久
|
亚洲美女av在线
|
欧美日韩视频一区二区三区
|
欧美亚洲视频
|
成人高清视频在线观看
|
日本免费视频在线观看
|
另类中文字幕
|
一级片免费在线视频
|
91成人在线
|
日韩视频一区二区三区
|
亚洲精品久久久久久久久久久
|
国产一区二区黄
|
国产精品呻吟久久av图片
|
国产精品国产精品国产专区不卡
|
| |









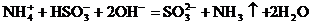
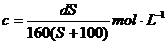 B.
B.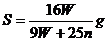
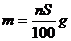 D.
D.