
科目: 來源: 題型:
【題目】設NA為阿伏伽德羅常數的數值,下列說法正確的是( )
A.12g NaHSO4晶體中陽離子和陰離子的總數為0.3NA
B.密閉容器中2 mol NO與1mol O2充分反應,產物的分子數目為2NA
C.在一定條件下,6.4g銅與過量的硫反應,轉移的電子數目為0.2NA
D.10g質量分數為46%的乙醇溶液中O-H鍵數目為0.7NA
查看答案和解析>>
科目: 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述正確的是( )
A.標準狀況下,33.6LHF中含有氟原子的數目為1.5NA
B.2.8gCO與C2H4的混合氣體中所含分子數為0.1NA
C.50 mL 18.4 mol·L-1濃硫酸與足量銅微熱反應,生成SO2分子的數目為0.46NA
D.含1molFeCl3的氯化鐵溶液完全水解生成Fe(OH)3膠體,其中膠粒數為NA
查看答案和解析>>
科目: 來源: 題型:
【題目】關于下列各圖的敘述,正確的是( )

A.甲表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱為483.6Kjmol﹣1
B.乙表示恒溫恒容條件下發生的可逆反應2NO2![]() N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態
N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態
C.丙表示A、B兩物質的溶解度隨溫度變化情況,將A、B飽和溶液分別由t1℃升溫至t2℃時,溶質的質量分數B>A
D.丁表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則同濃度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目: 來源: 題型:
【題目】關于一些重要的化學概念有下列說法,其中正確的是( )
①Fe(OH)3膠體和CuSO4溶液都是混合物 ②BaSO4是一種難溶于水的強電解質 ③冰醋酸、純堿、小蘇打分別屬于酸、堿、鹽 ④煤的干餾、煤的氣化和液化都屬于化學變化 ⑤置換反應都屬于離子反應
A.①②⑤B.①②④C.②③④D.③④⑤
查看答案和解析>>
科目: 來源: 題型:
【題目】以煤為原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
請寫出甲醇燃燒生成H2O(g)的熱化學方程式_________;
(2)向1L密閉容器中加入2mol CO、4mol H2,在適當的催化劑作用下,發生反應:2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①該反應能否_________自發進行(填“能”、“不能”或“無法判斷”)
②下列敘述能說明此反應達到平衡狀態的是_________.
a.混合氣體的平均相對分子質量保持不變
b.CO和H2的轉化率相等
c.CO和H2的體積分數保持不變
d.混合氣體的密度保持不變
e.1mol CO生成的同時有1mol O-H鍵斷裂
(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0在一定條件下,某反應過程中部分數據如下表:
CH3OH(g)+H2O(g)△H<0在一定條件下,某反應過程中部分數據如下表:
反應條件 | 反應時間 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒溫 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10min內,用H2O(g)表示的化學反應速率v(H20)=_________mol/(L·min)
②達到平衡時,該反應的平衡常數K=_________(用分數表示),平衡時H2的轉化率是_________。
③在其它條件不變的情況下,若30min時改變溫度為T
(4)用甲醚(CH3OCH3)作為燃料電池的原料,請寫出在堿性介質中電池負極反應式_________.
查看答案和解析>>
科目: 來源: 題型:
【題目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六種粒子,屬于同一氧化還原反應中的反應物和生成物,下列敘述不正確的是
六種粒子,屬于同一氧化還原反應中的反應物和生成物,下列敘述不正確的是
A.被氧化和被還原的離子數目比為![]()
B.該反應說明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 發生氧化反應,轉移
發生氧化反應,轉移![]()
D.若利用該反應設計原電池,則負極反應為:![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】元素![]() 、
、![]() 、
、![]() 在周期表中的相對位置如圖所示。已知
在周期表中的相對位置如圖所示。已知![]() 元素原子的外圍電子排布式為
元素原子的外圍電子排布式為![]() ,則下列說法不正確的是( )
,則下列說法不正確的是( )
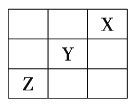
A.![]() 元素原子的價電子排布式為
元素原子的價電子排布式為![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金屬元素最多
元素所在周期中所含非金屬元素最多
D.![]() 元素原子的核外電子排布式為
元素原子的核外電子排布式為![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】市場上經常見到的標記為Li-ion的電池。它的負極材料是金屬鋰和碳的復合材料(碳作為金屬鋰的載體),電解質為一種能傳導Li+的高分子材料。這種鋰離子電池的電池反應式為: Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列說法正確的是
2Li0.85NiO2,下列說法正確的是
A. 充電時,該電池的正極應外接電源負極
B. 充電時,Li0.85NiO2既發生氧化反應又發生還原反應
C. 該電池既能用酸溶液又能用堿溶液作電解質溶液。
D. 放電過程中Li+向負極移動
查看答案和解析>>
科目: 來源: 題型:
【題目】溶液中的化學反應大多是離子反應。根據要求回答下列問題:
(1)Na2CO3溶液顯堿性的原因,用離子反應方程式表示_____________________________;CuSO4溶液呈酸性的原因,用離子反應方程式表示:___________________________。
(2)25 ℃時,pH為9的CH3COONa溶液中c(OH-)=________。
(3)25 ℃時,將a mol·L-1氨水與0.01 mol·L-1鹽酸等體積混合,反應平衡時溶液中c(NH![]() )=c(Cl-),則溶液顯________(填“酸”“堿”或“中”)性。用含a的代數式表示NH3·H2O的電離常數Kb=___________。
)=c(Cl-),則溶液顯________(填“酸”“堿”或“中”)性。用含a的代數式表示NH3·H2O的電離常數Kb=___________。
查看答案和解析>>
科目: 來源: 題型:
【題目】Mg-LiFePO4電池的電池反應為![]() ,其裝置示意圖如下:(鋰離子導體膜只允許Li+通過)。下列說法正確的是
,其裝置示意圖如下:(鋰離子導體膜只允許Li+通過)。下列說法正確的是

A.放電時,Li+被還原
B.放電時,電路中每流過2 mol電子,有1 mol Mg2+遷移至正極區
C.充電時,陽極上發生的電極反應為:![]()
D.充電時,導線上通過1 mol電子,左室溶液質量減輕12 g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com