
科目: 來源: 題型:
【題目】(化學---選修5有機化學基礎)2005年諾貝爾化學獎授予了研究烯烴復分解反應的科學家,以表彰他們作出的卓越貢獻。烯烴復分解反應原理如下:現以烯烴C5H10為原料,合成有機物M和N,合成路線如下:
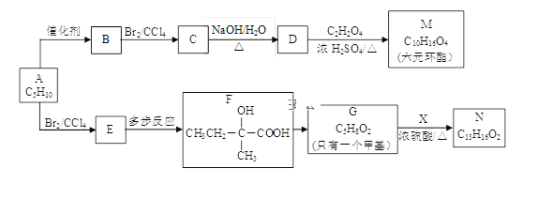
(1)按系統命名法,有機物A的名稱是___________。
(2)B的結構簡式是___________。
(3)寫出D![]() M的化學方程式___________。
M的化學方程式___________。
(4)寫出E![]() F合成路線(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)___________。
F合成路線(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)___________。
(5)已知X的苯環上只有一個取代基,且取代基無甲基,則N的結構簡式為_________。
(6)滿足下列條件的X的同分異構體共有_____種,寫出任意一種的結構簡式_____。
①遇FeCl3溶液顯紫色 ②苯環上的一氯取代物只有兩種
查看答案和解析>>
科目: 來源: 題型:
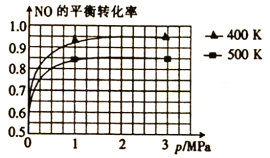
【題目】2017年5月5日,中國首架按照國際標準研制,擁有自主知識產權的大型客機C-919在上海浦東機場首飛,科學家在實驗室研究利用催化技術將飛機尾氣中的NO和CO轉變成CO2和N2,其反應為2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
(1)上述反應的熵變ΔS__0(填“>”“<”或“=”,下同),該反應能夠自發進行,則反應的ΔH__0。
(2)假設在密閉容器中發生上述反應,達到平衡時下列措施能提高NO轉化率的是__(填字母代號,下同)
A.選用更有效的催化劑 B.升高反應體系的溫度
C.降低反應體系的溫度 D.縮小容器的體積
(3)一定溫度下,將體積比為1∶2的NO、CO氣體置于恒容密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是___。
A.體系壓強保持不變
B.混合氣體顏色保持不變
C.N2和CO2的物質的量之比保持不變
D.每生成1molN2的同時生成2molNO
(4)已知上述反應中NO的平衡轉化率與壓強、溫度的關系如圖所示。工業上催化裝置比較適合的溫度和壓強是__。
A.400K;3MPa B.400K;1.5MPa C.400K;1MPa D.500K;1MPa
查看答案和解析>>
科目: 來源: 題型:
【題目】有一瓶澄清的溶液,只可能含有 NH4+、Na+、Mg2+、Ba2+、Fe3+、Clˉ、Brˉ、Iˉ、CO32ˉ、SO42—中的幾種,且濃度均為 0.1mol L—1。進行以下實驗:
①取少量溶液,滴加鹽酸至溶液呈酸性,無明顯現象。
②取少量溶液,滴加少許新制氯水,再加淀粉溶液,溶液變藍
③取少量溶液,向其中逐滴加入 NaOH 溶液至堿性,過程中均無沉淀產生。將此溶液分為兩等份,第一份加熱,有氣體放出;第二份溶液中加入Na2CO3 溶液,有白色沉淀生成。下列結論不正確的是
A.肯定含有的陽離子是 NH4+、Ba2+
B.肯定含有的陰離子是Iˉ、Clˉ、Brˉ
C.肯定不含有的離子是 Fe3+、CO32ˉ、SO42ˉ
D.不能確定是否含有的離子是 Na+
查看答案和解析>>
科目: 來源: 題型:
【題目】有一無色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等離子的幾種,為分析其成分,取此溶液分別進行了四個實驗,其操作和有關現象如圖所示:

請你根據上圖推斷:
(1)原溶液中一定存在的陰離子有_______________,顯___(填“酸”“堿”或“中”)性。
(2)實驗③中產生無色無味氣體所發生的化學方程式為__________________________________。
(3)寫出實驗④中A點對應沉淀的化學式:__________。
(4)寫出實驗④中,由A→B過程中所發生反應的離子方程式:________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室以磷石膏(主要含CaSO4,還含少量SiO2、Fe2O3)為原料制取輕質 CaCO3,其實驗流程如下:
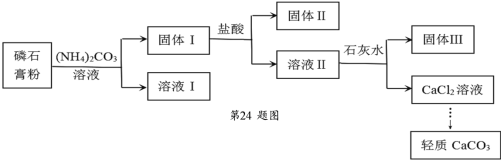
下列說法不正確的是
A.固體Ⅰ、固體Ⅱ中含有 SiO2,固體Ⅲ中含有 Fe(OH)3
B.由固體Ⅰ為原料制備 CaCl2 溶液使用的鹽酸和石灰水均要過量
C.加入(NH4)2CO3 溶液的離子方程式為:CaSO4+CO32ˉ=CaCO3+SO42ˉ
D.檢驗固體Ⅰ洗滌是否完全,可取最后一次洗滌液往其中滴加鹽酸酸化的 BaCl2 溶液,看有無沉淀生成
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學幫助水質監測站配制480 mL 0.5 mol·L-1NaOH溶液以備使用。


(1)該同學應選擇____mL的容量瓶。
(2)其操作步驟如圖所示,則上圖框中操作應在圖中__________ (填選項字母)之間。
A.②與③ B.①與② C.③與④
(3)該同學應稱取NaOH固體____g,用質量為23.1 g的燒杯放在托盤天平上稱取所需NaOH固體時,請在附表中選取所需的砝碼大小____(填字母),并在下圖中選出能正確表示游碼位置的選項____(填字母)。
附表 砝碼規格
a | b | c | d | e | |
砝碼大小/g | 100 | 50 | 20 | 10 | 5 |

(4)下列操作對所配溶液的濃度大小有何影響(填“偏大” “偏小”或“無影響”)。
①定容時,俯視讀數,濃度會________;②轉移溶液過程中,少量液體濺出來,濃度會____________;
③容量瓶未干燥,濃度會__________;
④定容搖勻后發現溶液凹面低于刻度線,濃度會______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】(化學--選修3 物質結構與性質)
二氧化碳和乙二醇在氧化鋅或鋅鹽催化下可合成碳酸乙烯酯。
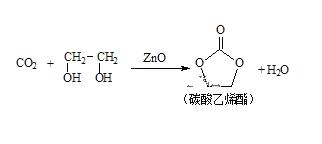
回答下列問題:
(1)鋅基態離子的價電子排布式為_______________。
(2)乙二醇中C、H、O的電負性大小關系是__________;碳酸乙烯酯中碳原子的雜化軌道類型有___________;1mol碳酸乙烯酯中含有的σ鍵的數目為_______NA。
(3)鋅鹽水溶液中Zn2+可與H2O之間形成[Zn(H2O)6]2+,[Zn(H2O)6]2+中所含化學鍵的類型為____。
(4)陰離子X-與CO2互為等電子體且X-內含共價鍵和氫鍵,則X-的化學式為______。
(5)一種鋅金合金晶體的立方體晶胞中,金原子位于頂點,鋅原子位于面心,若該晶體的晶胞棱長為apm(1pm=10-12m),則該合金的密度為_______g·cm-3(用NA表示阿伏加德羅常數的值,列出算式不要求結果)。
查看答案和解析>>
科目: 來源: 題型:
【題目】有Al2(SO4)3和Na2SO4的混合溶液V L,將它均分成兩份。一份滴加氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO![]() 完全沉淀。反應中消耗a mol NH3·H2O、b mol BaCl2。據此得知原混合溶液中的c(Na+)(mol·L-1)為( )
完全沉淀。反應中消耗a mol NH3·H2O、b mol BaCl2。據此得知原混合溶液中的c(Na+)(mol·L-1)為( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值。下列敘述正確的是( )
A.密閉容器中2 mol NO與1 mol O2充分反應,產物的分子數為2NA
B.一定溫度下,1 L 0.50 mol·L-1 NH4NO3溶液中含氮原子個數為NA
C.過氧化氫分解制得標準狀況下1.12 L O2,轉移電子數目為0.2NA
D.28 g鐵在反應中作還原劑且完全反應時,失去電子的數目一定為NA
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)如圖為測定中和熱的實驗裝置圖。請回答下列問題:
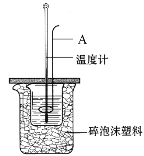
①儀器A的名稱為___;
②如果用0.50mol·L-1的鹽酸和氫氧化鈉固體進行實驗,則實驗中所測出的“中和熱”的數值將___(填“偏大”、“偏小”或“不變”)
(2)近期發現,H2S是繼NO、CO之后的第三個生命體系氣體信號分子,它具有參與調節神經信號傳遞、舒張血管減輕高血壓的功能。如圖是通過熱化學循環在較低溫度下由水或硫化氫分解制備氫氣的反應系統原理。

①根據如圖,請寫出系統(II)中制氫的熱化學方程式___;
②系統(I)和系統(II)相比,制得等量H2所需能量較少的是__(填“I”或“II”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com