
科目: 來源: 題型:
【題目】如圖所示是由4個碳原子結合成的4種有機物(氫原子沒有畫出)
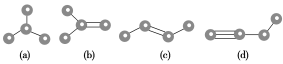
(1)寫出有機物(a)的系統命名法的名稱________________________。
(2)有機物(a)有一種同分異構體,試寫出該同分異構體的結構簡式________。
(3)上述有機物中與(c)互為同分異構體的是______(填代號)。
(4)任寫一種與(d)互為同系物的有機物的結構簡式________。
(5)(a)、(b)、(c)、(d)四種物質中,4個碳原子一定處于同一平面的有________(填代號)
查看答案和解析>>
科目: 來源: 題型:
【題目】金屬鎳及其化合物在合金材料以及催化劑等方面應用廣泛。請回答下列問題:
(1)鎳元素基態原子的價電子排布式為________;3d能級上的未成對的電子數為________。
(2)硫酸鎳溶于氨水形成![]() 藍色溶液,
藍色溶液,![]() 中配體的空間構型是________,陰離子的空間立體構型是________。
中配體的空間構型是________,陰離子的空間立體構型是________。
(3)NiO、FeO的晶體結構類型均與氯化鈉的相同,Ni2+和Fe2+的離子半徑分別為69pm和78pm,則熔點NiO________FeO(填“![]() ”或“
”或“![]() ”)。
”)。
(4)元素銅與鎳的第二電離能分別為:I(Cu)=1959kJ/mol,I(Ni)=1753kJ/mol,I(Cu)> I(Ni)的原因是________。
(5)金屬鎳與鑭(La)形成的合金是一種良好的儲氫材料,其晶胞結構示意圖如圖甲所示。該合金的化學式為________。
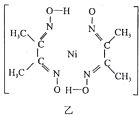
(6)丁二酮肟常用于檢驗Ni2+:在稀氨水中,丁二酮肟與Ni2+反應生成鮮紅色沉淀,其結構如圖乙所示。該結構中,除共價鍵外還存在配位鍵和氫鍵。請在圖中用“→”和“…”表示出配位鍵和氫鍵。(提示:Ni2+的配位數為4)________。
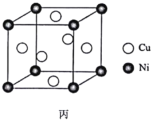
(7)某鎳白銅合金的立方晶胞結構如圖丙所示。若合金的密度為dg·cm-3,晶胞參數a=________nm。

查看答案和解析>>
科目: 來源: 題型:
【題目】設NA是阿伏加德羅常數的值,下列說法正確的是
A.28g乙烯和環丙烷的混合氣體中所含原子總數為6NA
B.1mol甘油(丙三醇)中含有羥基數為2.0NA
C.1mol的羥基與1mol的氫氧根離子所含電子數均為9NA
D.標準狀況下,2.24L己烷含有分子的數目為0.1NA
查看答案和解析>>
科目: 來源: 題型:
【題目】經最新研究發現,NOx和SOx是形成霧霾天氣的主要原因之一,因此研究NOx、SOx等大氣污染物的妥善處理具有重要意義。
(1)為了消除NO造成的污染,通常采用一氧化碳和氫氣進行催化還原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJmol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJmol-1;
③H2O(g)=H2O(l) ΔH=ckJmol-1。
寫出H2與NO反應生成N2和水蒸氣的熱化學方程式:________________________。
(2)目前應用最廣泛的煙氣氮氧化物脫除技術是NH3催化還原氮氧化物(SCR)技術。反應原理如圖所示:
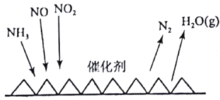
當NO2與NO的物質的量之比為1:1時,與足量氨氣在一定條件下發生反應。當有12mol電子發生轉移時,則參與反應的NO2的物質的量為________。
(3)T1溫度時在容積為2L的恒容密閉容器中發生反應:2NO(g)+O2(g)![]() 2NO2(g) ΔH<0。實驗測得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆為速率常數只受溫度影響。不同時刻測得容器中n(NO)、n(O2)如表:
2NO2(g) ΔH<0。實驗測得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆為速率常數只受溫度影響。不同時刻測得容器中n(NO)、n(O2)如表:
時間/ | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①從0~2s該反應的平均速率v(NO2)=________mol/(Ls)。
②T1溫度時,上述反應的化學平衡常數K=________。
③若將容器的溫度改變為T2時其k正=k逆,則T1________T2(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(4)電解硝酸工業的尾氣NO可制備NH4NO3,其工作原理如圖。
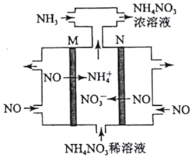
①N極的電極反應式為________________________。
②將電解生成的HNO3全部轉化為NH4NO3,則通入的NH3與實際參加反應的NO的物質的量之比至少為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某分子的球棍模型如圖所示。已知分子中所有原子的最外層均達到8電子穩定結構,原子間以單鍵相連。下列有關說法中錯誤的是( )

A. X原子可能為第ⅤA族元素
B. Y原子一定為第ⅠA族元素
C. 該分子中既含有極性共價鍵又含有非極性共價鍵
D. 從圓球的大小分析,該分子可能為N2F4
查看答案和解析>>
科目: 來源: 題型:
【題目】下列有關事實及原因的分析中,錯誤的是![]()
![]()
事實 | 原因 | |
A. | 分子內不同化學鍵之間存在鍵角 | 共價鍵具有方向性 |
B. |
|
|
C. | 不含金屬元素的化合物均是共價化合物 | 非金屬元素間不能形成離子鍵 |
D. |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 來源: 題型:
【題目】氫能源是最具應用前景的能源之一,高純氫的制備是目前的研究熱點。甲烷水蒸氣催化重整是制高純氫的方法之一。
(1)反應器中初始反應的生成物為H2和CO2,其物質的量之比為4∶1,甲烷和水蒸氣反應的方程式是___。
(2)已知反應器中還存在如下反應:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
反應iii為積炭反應,利用ΔH1和ΔH2計算ΔH3時,還需要利用__(寫化學方程式)反應的ΔH。
(3)反應物投料比采用n(H2O)∶n(CH4)=4∶1,大于反應的計量數之比,目的是__(填字母)。
a.促進CH4轉化 b.促進CO轉化為CO2 c.減少積炭生成
(4)用CaO可以去除CO2。H2體積分數和CaO消耗率隨時間變化關系如圖所示。從t1時開始,H2體積分數顯著降低,單位時間CaO消耗率__(填“升高”“降低”或“不變”)。此時CaO消耗率約為35%,但已失效,因為此時CaO主要發生了__(寫化學方程式)反應而使(1)中反應平衡向__移動。

(5)以甲醇為燃料,氧氣為氧化劑,KOH溶液為電解質溶液,可制成燃料電池。以此電池作電源,在實驗室中模擬鋁制品表面“鈍化”處理過程(裝置如圖所示)。其中物質a是__,電源負極電極反應為___。“鈍化”裝置中陽極電極反應為___。

查看答案和解析>>
科目: 來源: 題型:
【題目】科學家最近研制出可望成為高效火箭推進劑的![]() (如下圖所示)。已知該分子中N-N-N鍵角都是108.1°,下列有關
(如下圖所示)。已知該分子中N-N-N鍵角都是108.1°,下列有關![]() 的說法正確的是
的說法正確的是

A. 分子中N、O間形成的共價鍵是非極性鍵
B. 分子中四個氮原子共平面
C. 該物質既有氧化性又有還原性
D. 15.2g該物資含有6.02×![]() 個原子
個原子
查看答案和解析>>
科目: 來源: 題型:
【題目】結合元素周期表,回答下列問題:
(1)表中的實線是元素周期表的部分邊界,請在圖 1 中用實線補全元素周期表 的邊界____________
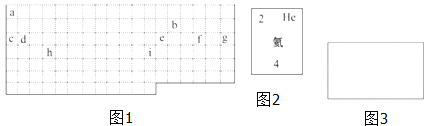
(2)表中所列元素,屬于短周期元素的有____________;屬于主族元素的有____________;g 元素位于第____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,請在如圖 3 所示的方框中按 氦元素(圖 2)的式樣寫出該元素的原子序數、元素符號、元素名稱、相對原子 質量_______.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com