
【題目】氫能源是最具應用前景的能源之一,高純氫的制備是目前的研究熱點。甲烷水蒸氣催化重整是制高純氫的方法之一。
(1)反應器中初始反應的生成物為H2和CO2,其物質的量之比為4∶1,甲烷和水蒸氣反應的方程式是___。
(2)已知反應器中還存在如下反應:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
反應iii為積炭反應,利用ΔH1和ΔH2計算ΔH3時,還需要利用__(寫化學方程式)反應的ΔH。
(3)反應物投料比采用n(H2O)∶n(CH4)=4∶1,大于反應的計量數之比,目的是__(填字母)。
a.促進CH4轉化 b.促進CO轉化為CO2 c.減少積炭生成
(4)用CaO可以去除CO2。H2體積分數和CaO消耗率隨時間變化關系如圖所示。從t1時開始,H2體積分數顯著降低,單位時間CaO消耗率__(填“升高”“降低”或“不變”)。此時CaO消耗率約為35%,但已失效,因為此時CaO主要發生了__(寫化學方程式)反應而使(1)中反應平衡向__移動。

(5)以甲醇為燃料,氧氣為氧化劑,KOH溶液為電解質溶液,可制成燃料電池。以此電池作電源,在實驗室中模擬鋁制品表面“鈍化”處理過程(裝置如圖所示)。其中物質a是__,電源負極電極反應為___。“鈍化”裝置中陽極電極反應為___。

【答案】CH4+2H2O![]() 4H2+CO2 C(s)+CO2(g)=2CO(g)或C(s)+2H2O(g)
4H2+CO2 C(s)+CO2(g)=2CO(g)或C(s)+2H2O(g)![]() 2H2(g)+CO2(g) abc 降低 CaO+H2O=Ca(OH)2 左(或逆向) 氧氣(或O2) CH3OH-6e-+8OH-=CO32-+6H2O 2Al+3H2O-6e-=Al2O3+6H+
2H2(g)+CO2(g) abc 降低 CaO+H2O=Ca(OH)2 左(或逆向) 氧氣(或O2) CH3OH-6e-+8OH-=CO32-+6H2O 2Al+3H2O-6e-=Al2O3+6H+
【解析】
(1)根據CH4與H2O反應生成H2、CO2的物質的量之比為4:1,結合原子守恒可得反應的化學方程式為CH4+2H2O![]() 4H2+CO2;
4H2+CO2;
(2)已知反應器中還存在如下反應:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
根據蓋斯定律,由i-ii-iii或i+ii- iii可得C(s)+CO2(g)=2CO(g)或C(s)+2H2O(g)![]() 2H2(g)+CO2(g),所以利用ΔH1和ΔH2計算ΔH3時,還需要利用C(s)+CO2(g)=2CO(g)或C(s)+2H2O(g)
2H2(g)+CO2(g),所以利用ΔH1和ΔH2計算ΔH3時,還需要利用C(s)+CO2(g)=2CO(g)或C(s)+2H2O(g)![]() 2H2(g)+CO2(g);
2H2(g)+CO2(g);
(3)反應物的投料比n(H2O):n(CH4)=4:1,大于初始反應的化學計量數之比,H2O 的物質的量增加,有利于促進CH4轉化,促進CO轉化為CO2,防止CH4分解生成C(s),從而減少積炭生成;答案選abc。
(4)根據題圖可知,從t1時開始,CaO 消耗率曲線的斜率逐漸減小,單位時間內CaO消耗率逐漸降低。CaO與CO2反應生成CaCO3, CaCO3會覆蓋在CaO表面,減少了CO2與CaO的接觸面積,從而失效;
(5) 模擬鋁制品表面“鈍化” 處理,則電極鋁是陽極,與電源的正極相連,則C為陰極,與電源的負極相連,所以a物質是氧氣, b物質是甲醇,負極的電極反應式為:CH3OH-6e-+8OH-=CO32-+6H2O。鋁為陽極,會發生氧化反應,表面形成氧化膜,必須有水參加,所以電極反應式為:2Al+3H2O-6e-=Al2O3+6H+。


 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案科目:高中化學 來源: 題型:
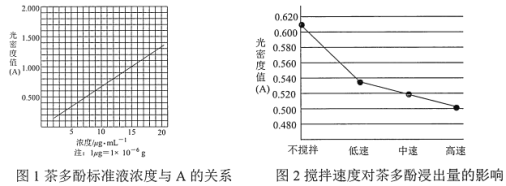
【題目】茶葉中的茶多酚是一種天然抗氧化劑(其抗氧化能力是 VC 的 5~10 倍),它易溶于水、乙醇、乙酸乙酯,難溶于氯仿。在酸性介質中,茶多酚能將 Fe3+還原為 Fe2+,Fe2+與 K3Fe(CN)6生成的深藍色配位化合物 KFe[Fe(CN)6]對特定波長光的吸收程度(用光密度值 A 表示)與茶多酚在一定濃度范圍內成正比。A 與茶多酚標準液濃度的關系如圖 1 所示:
某實驗小組設計如下實驗流程從茶葉中提取茶多酚:
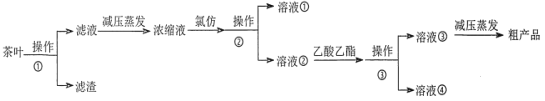
請回答下列問題:
(1)操作①用水浸取茶多酚時,實驗小組發現攪拌速度對茶多酚浸出量的影響如圖 2 所示,原因是____。若用乙醇浸取茶多酚操作如下:稱取 10 g 茶葉末,用濾紙包好,裝入恒壓滴液漏斗中,圓底燒瓶內加沸石和適量乙醇,如圖 3 安裝后, 通冷凝水,加熱套加熱,當乙醇被加熱沸騰后,控制加熱套溫度在 90℃。為使恒壓漏斗內液面高出茶葉包約 0.5 cm,并保持約 1 h,可行的操作方法是________。
(2)減壓蒸發相對于一般蒸發的優點是________;氯仿的作用是________。
(3)下列有關實驗基本操作不正確的是________。
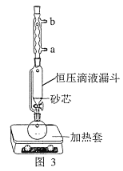
A.圖 3 中冷凝水流向為 a 進 b 出
B.分液漏斗使用前須檢驗是否漏水并洗凈備用
C.操作①過濾時,可用玻璃棒適當攪拌以加快分離速度
D.萃取過程中,經振搖并放氣后,將分液漏斗置于鐵圈上立即分液
(4)稱取 1.25 g 粗產品,用蒸餾水溶解并定容至 1000 mL,移取該溶液 1.00 mL,加過量 Fe3+和 K3Fe(CN)6 酸性溶液,用蒸餾水定容至 100 mL 后,測得溶液光密度值 A=0.800,則產品的純度是_____ (以質量分數表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3kJ·mol-1,②H2(g)+![]() O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有關說法正確的是( )
O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有關說法正確的是( )
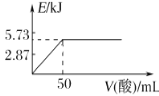
A.向含0.1molNaOH的溶液中加入一定體積的0.1mol·L-1乙二酸,反應中的能量變化如圖所示
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
C.氫氣的燃燒熱為 ΔH=-241.8kJ·mol-1
D.氫氣的燃燒熱為 ΔH=-483.6kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗測得0.5mol·L1CH3COONa溶液、0.5mol·L1CuSO4溶液以及H2O的pH隨溫度變化的曲線如圖所示。下列說法不正確的是( )

A.當溫度為50℃時,純水中c(H+)=c(OH)
B.隨溫度升高,CuSO4溶液的c(H+)增大
C.隨溫度升高,CH3COONa溶液的pH變化與Kw改變有關
D.隨溫度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因為CH3COO-、Cu2+水解平衡移動方向不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數依次增大,四種元素可以組成一種分子簇,其分子結構如圖所示(球的大小表示原子半徑的相對大小),W、X位于不同周期,X原子的最外層電子數是次外層電子數的3倍,Z的族序數等于其周期數,下列說法中正確的是( )。
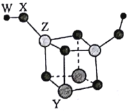
A.W和X可以組成原子個數比為2:1和1:1的離子化合物
B.工業上可采用電解Z的熔融氯化物的方法制得單質Z
C.Z的最高價氧化物對應水化物的堿性比Y的強
D.X、Y、Z三種元素的離子半徑由小到大順序為Z<Y<X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA是阿伏加德羅常數的值,下列說法正確的是
A.28g乙烯和環丙烷的混合氣體中所含原子總數為6NA
B.1mol甘油(丙三醇)中含有羥基數為2.0NA
C.1mol的羥基與1mol的氫氧根離子所含電子數均為9NA
D.標準狀況下,2.24L己烷含有分子的數目為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有機物A、B、C、D、E、F之間的轉化關系如圖所示。D常用作汽車發動機的抗凍劑,E為聚合物,F的相對分子質量為26。

根據信息回答下列問題。
(1)寫出A中官能團名稱:________。
(2)B轉化為C的反應類型為________。
(3)有機物D具有以下哪幾方面的化學性質:______(填序號)。
①加成反應 ②取代反應 ③消去反應 ④氧化反應 ⑤還原反應
(4)E的結構簡式為__________。
(5)C→F反應的方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的制備與工業生產相符的是
A.N2![]() NO
NO![]() HNO3
HNO3
B.濃HCl![]() Cl2
Cl2![]() 漂白粉
漂白粉
C.MgCl2(aq)![]() 無水MgCl2
無水MgCl2![]() Mg
Mg
D.飽和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com