
科目: 來源: 題型:
【題目】聚乙二醇(PEG)是一種非離子性惰性溶劑和綠色有機合成的重要催化劑,如圖是合成PEG等的簡單流程,其中E是一種聚碳酸酯高分子化合物。
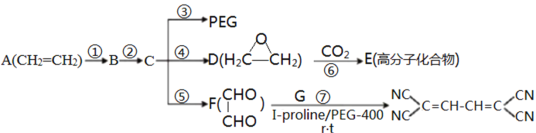
已知①RCH2Cl![]() RCH2CN
RCH2CN
②R’CHO+RCH2CN![]() +H2O
+H2O
請根據以上信息回答下列問題:
(1)反應②所需的試劑和反應條件___;反應⑥的反應類型是___。
(2)物質F的名稱為___。
(3)物質E的結構簡式為___;反應⑦的另一種產物為水,則G的結構簡式為___。
(4)反應③的化學方程式為___。
(5)M與D的組成元素相同,且M中各原子數目為D中各原子數目的2倍,寫出符合下列條件的M的結構簡式___ (只寫一種)。
a.能與新制的氫氧化銅懸濁液反應生成磚紅色沉淀
b.能在稀硫酸中發生水解反應
(6)寫出以乙烯為原料合成![]() 的路線圖,其它無機試劑任選___。
的路線圖,其它無機試劑任選___。
查看答案和解析>>
科目: 來源: 題型:
【題目】用堿性氫氧燃料電池為電源進行電解的實驗裝置示意圖如圖所示。下列說法中正確的是( )

A.燃料電池工作時負極反應為:H2=2H++2e-
B.若要實現鐵上鍍銅,則a極是鐵,b極是銅
C.若要實現電解精煉粗銅,則a極發生氧化反應,b極上有銅析出
D.a、b兩極均是石墨時,在相同條件下,當電池中消耗H222.4L(標準狀況)時,a極析出銅64g
查看答案和解析>>
科目: 來源: 題型:
【題目】向一定量的Cu、Fe2O3的混合物中加入400 mL 1 mol·L-1的鹽酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用過量的CO在高溫下還原相同質量的原混合物,固體減少的質量為
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
查看答案和解析>>
科目: 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是

A. 通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B. 該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C. 負極反應為2H2O–4e–=O2+4H+,負極區溶液pH降低
D. 當電路中通過1mol電子的電量時,會有0.5mol的O2生成
查看答案和解析>>
科目: 來源: 題型:
【題目】水合肼(N2H4H2O)是無色、有強還原性的液體,能與水、醇任意混合,不溶于乙醚和氯仿。實驗室制備水合肼的原理為:CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4H2O+NaCl,據此,某學生設計了下列實驗。
已知:①NaClO受熱易分解為NaCl和NaClO3
②N2H4H2O的沸點約118℃
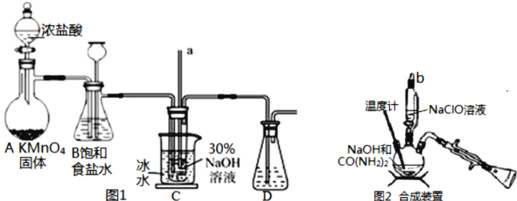
Ⅰ.制備NaClO溶液(如圖1)
(1)用燒堿固體配制30%NaOH溶液時,所需玻璃儀器除玻璃棒外還有___(填字母)。
A.容量瓶 B.移液管 C.燒杯 D.量筒
(2)B中的長頸漏斗和C中的玻璃管a在實驗中的作用相同,均為___。C中用冰水浴控制溫度在25℃以下,其主要目的是___。
Ⅱ.制取水合肼(如圖2)
(3)實驗中要滴入NaClO溶液___(選填“需要”或“不需要”)打開玻璃塞b。
(4)反應過程中,若將CO(NH2)2滴加到NaClO中,將會產生大量氮氣,降低水合肼的產率,原因是___(用化學方程式表示)。充分反應后,把“合成裝置”內的溶液經過___(填操作)處理,即可得到水合肼的粗產品。
Ⅲ.定量測定
(5)稱取餾分0.20g,加水配成20.00mL溶液,在一定條件下,用0.30molL-1I2的標準液進行滴定。
①滴定時,用___(填儀器名稱)裝標準液。
②水合肼與I2反應的化學方程式為___。
③實驗測得消耗I2溶液的平均值為20.00mL,則餾分中N2H4H2O的質量分數為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】B、C、N、Mg、Al、Si均是重要短周期元素,其化合物在工業中有重要用途。請回答下列問題:
(1)硼氫化合物B2H6的結構如圖所示,則B原子的雜化方式為___。2個硼原子與4個氫原子形成普通的σ鍵。這四個σ鍵在同一平面上,另外兩個氫原子和這兩個硼原子形成了兩個垂直于該平面的“氫橋鍵”,該“氫橋鍵”為___中心___(原子)電子鍵(填阿拉伯數字)。
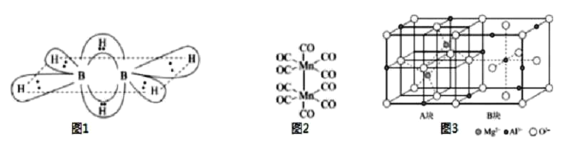
(2)CF4和PF3的沸點比較CF4___PF3(選填“>”或“<”)。PCl5中P原子采用sp3d雜化,形成三角雙錐結構,而N原子只能形成NCl3,不能形成NCl5的原因是___。
(3)基態Mn原子核外特征電子排布式為___;已知CO的結構為C![]() O,Mn2(CO)10(結構如圖2)中π鍵與配位鍵的個數比為___。
O,Mn2(CO)10(結構如圖2)中π鍵與配位鍵的個數比為___。
(4)環狀基型硅酸鹽中硅氧四面體共角氧相連,并封閉成環,分單層環與雙層環兩大類,雙層三環Si6O15,雙層四環Si8O20、雙層六環Si12O30、雙層n環Si2nOm,當n=10時,m=___。
(5)尖晶石的結構如圖3所示,請寫出尖晶石的化學式___;A塊、B塊均為邊長為apm的立方體,設阿伏伽德羅常數的值為NA,最近兩個Al3+之間的距離為___pm,尖晶石的密度為___g/cm3(列出計算式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】右圖為某種乙醇燃料電池示意圖,工作時電子流方向如圖所示,下列判斷正確的是

A.X為氧氣
B.電極A反應式:CH3CH2OH-12e-+3H2O=2CO2+12H+
C.電極材料活潑性:A>B
D.B電極附近溶液pH增大
查看答案和解析>>
科目: 來源: 題型:
【題目】丙烯是一種重要的有機化工原料,用于制丙烯腈、環氧丙烷、丙酮等。回答下列問題:
(1)已知Ⅰ.C3H8(g)![]() C3H6(g)+H2(g) △H1=+124kJ/mol
C3H6(g)+H2(g) △H1=+124kJ/mol
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
則丙烷氧化脫氫制丙烯的反應2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g)的△H為___kJ/mol。
2C3H6(g)+2H2O(g)的△H為___kJ/mol。
(2)我國學者結合實驗與計算機模擬結果,研究了丙烷在六方氮化硼催化劑表面氧化脫氫制丙烯的反應歷程,部分歷程如圖所示,其中吸附在催化劑表面的物種用*標注。

①如圖歷程中決速步驟能壘(活化能)為___ eV。該歷程中最低能壘對應的化學方程式為___。
②圖示歷程之后可能發生的化學反應方程式為___。
(3)已知丙烷氧化脫氫容易發生副反應:2C3H8(g)+O2(g)![]() 3C2H4(g)+2H2O(g)。如圖所示是丙烷氧化脫氫制丙烯反應達平衡時丙烷轉化率與丙烯選擇性隨溫度變化的曲線。
3C2H4(g)+2H2O(g)。如圖所示是丙烷氧化脫氫制丙烯反應達平衡時丙烷轉化率與丙烯選擇性隨溫度變化的曲線。

(丙烯的選擇性=![]() ×100%)
×100%)
①丙烯的選擇性隨溫度升高而降低的可能原因有___。
②在反應溫度為600℃,將C3H8與O2以體積比1:1充入剛性容器中,達到平衡時,丙烷轉化率為40%,丙烯的選擇性也為40%,體系總壓強為pkPa,則氧氣的轉化率α(O2)=___,丙烯的分壓p(C3H6)=___(結果保留2位有效數字)。
查看答案和解析>>
科目: 來源: 題型:
【題目】某容積為1L的密閉容器中通入1mol CO2和3mol H2,發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有關說法正確的是
CH3OH(g)+H2O(g) ΔH<0。下列有關說法正確的是
A. 該反應在高溫下才能自發進行
B. 再加入一定量CO2,則n(CH3OH)/n(CO2)減小
C. 溫度升高,反應的平衡常數K增大
D. 當CO2和H2轉化率相等時,該反應達到化學平衡
查看答案和解析>>
科目: 來源: 題型:
【題目】甲、乙、丙、丁四種物質中,甲、乙、丙均含有相同的某種元素,它們之間具有如下轉化關系:甲![]() 乙
乙![]() 丙。下列有關物質的推斷不正確的是( )
丙。下列有關物質的推斷不正確的是( )
A.若甲為Cl2,則丁可能是鐵B.若甲為鐵,則丁可能是硝酸
C.若甲為AlCl3溶液,則丁可能是氨水D.若甲為NaOH,則丁可能是CO2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com