
科目: 來源: 題型:選擇題
| A. | HCI和NaOH反應的中和熱△H=-57.3kJ?mol-1,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3)kJ?mol-1 | |
| B. | 需要加熱才能發生的反應一定是吸熱反應 | |
| C. | CO(g)的燃燒熱是283.0kJ?mol-1,則2CO2(g)═2CO(g)+O2(g)反應的△H=+2×283.0kJ?mol-1 | |
| D. | 1 mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 用含0.lmolFeCl3的溶液與足量沸水反應制得的Fe(0H)3膠體中膠粒數為0.1NA | |
| B. | 46g N02和N204的混合氣體中含原子總數為NA | |
| C. | 標準狀況下,5.6L CCl4含有的分子數為0.25NA | |
| D. | 0.25 mol Na2O2中含有的陰離子數為0.5 NA |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | C02的電子式::$\underset{\stackrel{…}{O}}{…}$:$\underset{\stackrel{…}{C}}{…}$:$\underset{\stackrel{…}{O}}{…}$ | B. | 中子數為20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 乙烯的比例模型 | D. | 鋁離子結構示意圖: |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A | B | c | D | |
| 用 品 |  |  |  |  |
| 主要成分 | CO2 | Fe2O3 | NaHCO3 | C12H22011 |
| 用途 | 做制冷劑 | 做紅色涂料 | 除油污 | 做調味劑 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 來源: 題型:解答題
 堿式碳酸銅是一種具有廣泛用途的化工產品,主要用于固體熒光粉激活劑和銅鹽的制造等.
堿式碳酸銅是一種具有廣泛用途的化工產品,主要用于固體熒光粉激活劑和銅鹽的制造等.| 實驗序號 | 樣品質量/g | CO2體積/mL(已折算成標準狀況下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 常溫常壓下,17g甲基(-14CH3)所含的中子數為9NA | |
| B. | 1 L 0.2 mol•L-1硫酸鐵溶液中含有的SO42-數為0.2NA | |
| C. | 0.1mol N2與足量的H2反應,轉移的電子數為0.6NA | |
| D. | 用惰性電極電解1L0.1mol•L-1 CuCl2溶液,當有0.2NA個電子通過時,可生成6.4g銅 |
查看答案和解析>>
科目: 來源: 題型:解答題
 .
.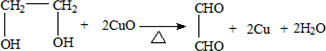 .
. .
.
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
 其反應的裝置示意圖如圖1(夾持裝置、加熱裝置略去):環己醇、環己酮、飽和食鹽水和水的部分物理性質見下表:
其反應的裝置示意圖如圖1(夾持裝置、加熱裝置略去):環己醇、環己酮、飽和食鹽水和水的部分物理性質見下表:| 物質 | 沸點(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 環己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 環己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 飽和食鹽水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 |

查看答案和解析>>
科目: 來源: 題型:解答題
 過氧乙酸常用作氧化劑和滅菌劑.實驗室合成過氧乙酸并測定其含量的相關步驟如下:
過氧乙酸常用作氧化劑和滅菌劑.實驗室合成過氧乙酸并測定其含量的相關步驟如下:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com