
科目: 來源: 題型:解答題
 某學習小組探究溴乙烷的消去反應并驗證產物.
某學習小組探究溴乙烷的消去反應并驗證產物.查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
| 物質 | 熔點/℃ | 沸點 | 化學性質 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S,300℃以上完全分解,S2Cl2+Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2 |

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:填空題

查看答案和解析>>
科目: 來源: 題型:解答題

| 開始沉淀時的pH | 完全沉淀時的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目: 來源: 題型:解答題

 .
.查看答案和解析>>
科目: 來源: 題型:解答題
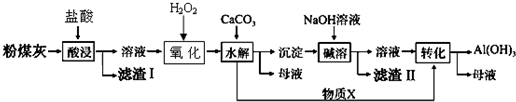
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目: 來源: 題型:解答題
 為除去粗鹽NaCl中的Ca2+、Mg2+、SO42-以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑均過量):
為除去粗鹽NaCl中的Ca2+、Mg2+、SO42-以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑均過量):查看答案和解析>>
科目: 來源: 題型:解答題

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 開始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com