
科目: 來源: 題型:選擇題
| A. | 分子式為C5H12O且可與金屬鈉反應放出氫氣的有機物有4種 | |
| B. | 甲苯分子中所有原子可能共面 | |
| C. | 苯、乙醇、油脂均不能使酸性KMnO4溶液褪色 | |
| D. | C3H2Cl6有四種同分異構體 |
查看答案和解析>>
科目: 來源: 題型:解答題
 工業上,可以由下列反應合成三聚氰胺:
工業上,可以由下列反應合成三聚氰胺: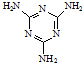 .其中氮原子的雜化方式有sp2、sp3.
.其中氮原子的雜化方式有sp2、sp3.查看答案和解析>>
科目: 來源: 題型:解答題
 (1)聯氨(N2H4)是一種高能燃料.工業上可以利用氮氣和氫氣制備聯氨.
(1)聯氨(N2H4)是一種高能燃料.工業上可以利用氮氣和氫氣制備聯氨.查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| 實驗操作(或設計) | 實驗現象 | 結論 | |
| A | 等體積pH=3的HA和HB兩種酸分別與足量的鋅反應,排水法收集氣體 | HA放出的氫氣多且反應速率快 | 酸性:HB>HA |
| B | 以鎂、鋁、氫氧化鈉溶液構成原電池 | 鎂表面有氣泡 | 鎂作原電池的負極 |
| C | 相同溫度下,等質量的大理石與等體積等濃度的鹽酸反應 | 粉狀大理石產生氣泡更快 | 反應速率: 粉狀大理石>塊狀大理石 |
| D | 向盛有10滴0.1mol•L-1 AgNO3溶液的試管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 NaI溶液 | 先有白色沉淀,后轉成黃色沉淀 | Ksp(AgCl )>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 來源: 題型:解答題
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半徑/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高價態 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低價態 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
 .
. ,其中心原子以sp3雜化軌道成鍵.
,其中心原子以sp3雜化軌道成鍵.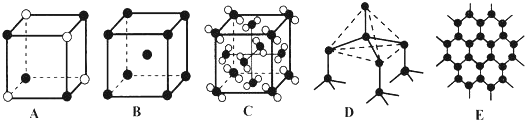
查看答案和解析>>
科目: 來源: 題型:解答題
| 元素 | A | B | C | D |
| 性質 結構 信息 | 基態原子核外有兩個電子層,最外層有3個未成對的電子 | 基態原子的M層有1對成對的p電子 | 基態原子核外電子排布為[Ar]3d104sx,有+1、+2兩種常見化合價 | 有兩種常見氧化物,其中有一種是冶金工業常用的還原劑 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com