
 工業上,可以由下列反應合成三聚氰胺:
工業上,可以由下列反應合成三聚氰胺: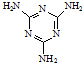 .其中氮原子的雜化方式有sp2、sp3.
.其中氮原子的雜化方式有sp2、sp3.分析 (1)Cu原子核外電子數為29,根據能量最低原理書寫核外電子排布式;
(2)原子總數相同、價電子總數(或電子總數)相同的微粒互為等電子體;
(3)CO(NH2)2中C原子與氧原子之間形成C=O雙鍵,C原子與N原子之間形成2個C-N單鍵,N原子與H原子之間共形成4個N-H鍵;
(4)環中N原子形成2個σ鍵,含有1對孤電子對,雜化軌道數目為3,氨基中N原子形成3個σ鍵,含有1對孤電子對,雜化軌道數目為4;
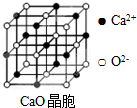
(5)以頂角O2-研究,與之最近的O2-位于面心,每個頂點為8故晶胞共用,每個面為兩個晶胞共用;
電荷越大、半徑越小,晶格能越大,離子晶體的熔點越高,電荷為主要影響原因.
解答 解:(1)Cu原子核外電子數為29,核外電子排布式為[Ar]3d104s1,故答案為:[Ar]3d104s1;
(2)原子總數相同、價電子總數(或電子總數)相同的微粒互為等電子體,與C22-的一種等電子體的化學式為:N2、CO、CN-等,故答案為:N2、CO、CN-等任寫一個;
(3)CO(NH2)2中C原子與氧原子之間形成C=O雙鍵,C原子與N原子之間形成2個C-N單鍵,N原子與H原子之間共形成4個N-H鍵,1mol 尿素分子[CO(NH2)2]中含有的π鍵與σ鍵的數目之比為1:7,故答案為:1:7;
(4)環中N原子形成2個σ鍵,含有1對孤電子對,雜化軌道數目為3,采取sp2雜化,氨基中N原子形成3個σ鍵,含有1對孤電子對,雜化軌道數目為4,采取sp3雜化,故答案為:sp2、sp3;
(5)以頂角O2-研究,與之最近的O2-位于面心,每個頂點為8故晶胞共用,每個面為兩個晶胞共用,故與之最近的O2-共有$\frac{3×8}{2}$=12;
CaO晶體的熔點比NaCl晶體的熔點高的主要原因是:CaO晶體中Ca2+、O2-的電荷數比NaCl晶體中Na+、Cl-大,CaO晶體的晶格能大,
故答案為:12;CaO晶體中Ca2+、O2-的電荷數比NaCl晶體中Na+、Cl-大,CaO晶體的晶格能大.
電荷越大、半徑越小,晶格能越大,離子晶體的熔點越高.
點評 本題是對物質結構的考查,涉及核外電子排布、化學鍵、雜化方式判斷、晶胞計算、離子晶體熔沸點比較等,是對學生綜合能力的考查,難度中等.


 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 新制氯水中只含Cl2和H2O兩種分子 | |
| B. | 新制氯水可使紫色石蕊溶液先變紅后褪色 | |
| C. | 久置的氯水pH增大,酸性增強 | |
| D. | 氯水經光照有氣泡逸出,該氣體是Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | A | B | C | D |
| 性質 結構 信息 | 基態原子核外有兩個電子層,最外層有3個未成對的電子 | 基態原子的M層有1對成對的p電子 | 基態原子核外電子排布為[Ar]3d104sx,有+1、+2兩種常見化合價 | 有兩種常見氧化物,其中有一種是冶金工業常用的還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素周期表有8個主族 | B. | 0族原子的最外層電子數均為8 | ||
| C. | ⅠA族的元素全是金屬元素 | D. | 短周期是指第1、2、3周期 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2、甲烷都屬于溫室氣體 | |
| B. | 用甘蔗生產的燃料乙醇屬可再生能源,利用乙醇燃料不會產生溫室氣體 | |
| C. | 太陽能、風能和生物質能屬于新能源 | |
| D. | 太陽能電池可將太陽能直接轉化為電能 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com