
科目: 來源: 題型:選擇題
 NaCI是一種化工原料,可以制備一系 列物質(如圖所示),下列說法正確的是( )
NaCI是一種化工原料,可以制備一系 列物質(如圖所示),下列說法正確的是( )| A. | 常溫干燥的Cl2能用鋼瓶儲存,所以Cl2不與鐵反應 | |
| B. | 工業上利用澄清石灰水與Cl2反應來制漂白粉 | |
| C. | 往NaCl溶液中先通足量氨氣后,再通入足量CO2才可能析出NaHCO3 | |
| D. | 電解含酚酞的NaCl溶液,由于OH-往陽極移動,故陽極先變紅 |
查看答案和解析>>
科目: 來源: 題型:解答題
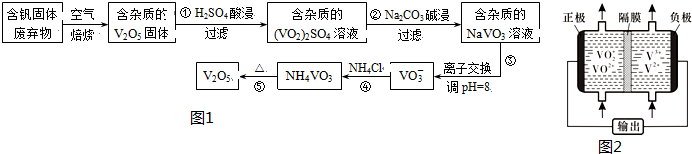
| 物質 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 難溶 | 難溶 | 可溶 | 易溶 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| 溫度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s時容器內c(Y)=0.76 mol/L | |
| B. | 830℃達平衡時,X的轉化率為80% | |
| C. | 反應達平衡后,升高溫度,平衡正向移動 | |
| D. | 1200℃時反應R(g)+Q(g)?X(g)+Y(g)的平衡常數K=0.4 |
查看答案和解析>>
科目: 來源: 題型:解答題
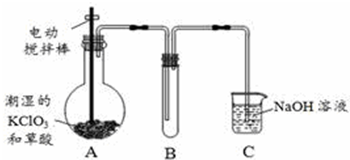
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 溫度升高,c(H2PO4-)增大 | |
| B. | 加水稀釋后,m(H+)與m(OH-)的乘積減少 | |
| C. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| D. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
 $→_{△}^{濃H_{2}SO_{4}}$
$→_{△}^{濃H_{2}SO_{4}}$ +H20
+H20| 相對分子質量 | 密度(g/cm3) | 沸點(℃) | 水中溶解性 | |
| 正丁酸 | 88 | 0.9587 | 163.5 | 溶 |
| 異戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 丁酸異戊酯 | 158 | 0.886 | 179 | 不溶 |

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目: 來源: 題型:解答題

 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com