
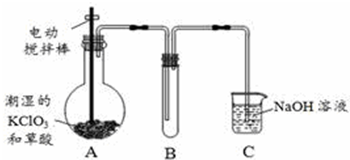
分析 (1)根據反應物、產物和反應條件寫出反應方程式;
(2)測量溫度的儀器是溫度計,二氧化氯的熔點較低,為收集二氧化氯,應在較低溫度下進行;
(3)從溶液中制取溶質,一般采用蒸發結晶、過濾、洗滌、干燥的方法;
(4)①根據配制一定物質的量濃度的溶液使用的儀器解答;
②二氧化氯具有氧化性,在酸性環境下,能將碘離子氧化;
③根據關系式2ClO2~5I2~10Na2S2O3計算c(ClO2);
④根據實驗操作中滴定液體積大小的影響來回答判斷.
解答 解:(1)加熱60℃,氯酸鉀和草酸反應生成碳酸鉀、二氧化碳、二氧化氯和水,反應方程式為:2KClO3+H2C2O4 $\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O,
故答案為:2KClO3+H2C2O4 $\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;
(2)要控制溫度必須使用溫度計測量溫度,二氧化氯的熔點較低,為收集二氧化氯,應在較低溫度下進行,所以應該采用冰水浴,
故答案為:溫度計;使ClO2充分冷凝,減少揮發;
(3)從溶液中制取溶質,一般采用蒸發結晶、過濾、洗滌、干燥的方法,為防止析出晶體NaClO2•3H2O,應趁熱過濾,
故答案為:蒸發濃縮結晶;趁熱過濾;
(4)①配制100mL溶液用到的儀器有托盤天平、藥匙、玻璃棒、膠頭滴管、燒杯、100mL容量瓶、量筒(可用可不用),故還需要的玻璃儀器有:100mL容量瓶、膠頭滴管,
故答案為:100mL容量瓶、膠頭滴管;
②二氧化氯具有氧化性,在酸性環境下,能將碘離子氧化,反應的原理方程式為:2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
故答案為:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;
③設原ClO2溶液的濃度為x,
2ClO2 ~5I2 ~10Na2S2O3
2mol 10mol
$\frac{0.01x×{V}_{1}×1{0}^{-3}}{0.1}$ 1×10-3cV2mol
x=$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L,
故答案為:$\frac{135c{V}_{2}}{{V}_{1}}$;
④若滴定前滴定管尖嘴中有氣泡,滴定后氣泡消失,則相當于消耗的滴定液的體積偏大,所以測定結果偏大;
若滴定開始仰視讀數,滴定終點時正確讀數,相當于消耗的滴定液體積偏小,所以結果偏小,
故答案為:偏高;偏小.
點評 本題考查實驗方案的設計,題目難度較大,明確物質的性質是解本題關鍵,試題側重考查學生分析問題、解決問題的能力,注意掌握化學實驗基本操作方法及中和滴定原理.


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
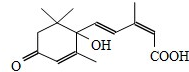 節日期間對大量盆栽鮮花施用S-誘抗素制劑,以保證鮮花盛開.S-誘抗素的分子結構如圖,下列說法正確的是( )
節日期間對大量盆栽鮮花施用S-誘抗素制劑,以保證鮮花盛開.S-誘抗素的分子結構如圖,下列說法正確的是( )| A. | 1mol該分子可與1molNa發生反應產生H2 | |
| B. | 分子中含有兩種官能團 | |
| C. | 可發生加成反應和取代反應 | |
| D. | 該分子不能使酸性高錳酸鉀溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有關粒子物質的量的變化如圖所示.下列有關說法正確的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有關粒子物質的量的變化如圖所示.下列有關說法正確的是| A. | H2A屬于強酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$隨著V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL時,溶液中存在關系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL時,溶液中存在關系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 裝置①中,鹽橋中的K+移向ZnSO4溶液 | |
| B. | 裝置②工作一段時間后,a極附近溶液的pH增大 | |
| C. | 用裝置③精煉銅時,c極為粗銅 | |
| D. | 裝置④電池負極的電極反應式為:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、無水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氫氧化銅懸濁液 | |
| D. | 苯酚鈉溶液、甲苯、乙酸乙酯、乙酸 飽和碳酸鈉溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應條件下,碳酸氫鈉難溶于水 | B. | 氨氣和二氧化碳均來自合成氨工廠 | ||
| C. | 侯氏制堿法實現了對氨氣循環利用 | D. | 生產時,應先通二氧化碳再通氨氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解水生成氫氣和氧氣時,電能轉化為化學能 | |
| B. | 煤燃燒時化學能主要轉化為熱能 | |
| C. | 綠色植物進行光合作用時,太陽能轉化為化學能 | |
| D. | 白熾燈工作時電能全部轉變成光能 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com