

| A. | 裝置①中,鹽橋中的K+移向ZnSO4溶液 | |
| B. | 裝置②工作一段時間后,a極附近溶液的pH增大 | |
| C. | 用裝置③精煉銅時,c極為粗銅 | |
| D. | 裝置④電池負極的電極反應式為:O2+4e-+2H2O=4OH- |
分析 A.Zn比Cu活潑,Zn失去電子為負極;
B.a(chǎn)與電源的負極相連,為陰極,氫離子在陰極上放電;
C.粗銅精煉時,粗銅為陽極;
D.為燃料電池,正極上氧氣得到電子.
解答 解:A.Zn比Cu活潑,Zn失去電子為負極,陽離子向正極移動,則鹽橋中的K+移向CuSO4溶液,故A錯誤;
B.a(chǎn)與電源的負極相連,為陰極,氫離子在陰極上放電,則裝置②工作一段時間后,a極上OH-濃度增大,a極附近溶液的pH增大,故B正確;
C.粗銅精煉時,粗銅為陽極,d與正極相連,則d極為粗銅,故C錯誤;
D.為燃料電池,正極上氧氣得到電子,則正極反應式為:O2+4e-+2H2O=4OH-,故D錯誤;
故選B.
點評 本題考查化學實驗方案的評價,為高頻考點,涉及原電池、電解原理及應用等,把握反應原理及實驗技能為解答的關鍵,側重分析與實驗能力的考查,注意實驗裝置的作用及分析,題目難度不大.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
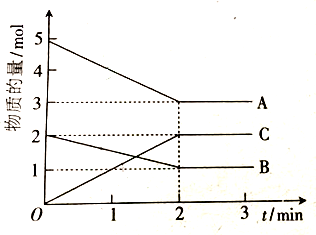
| 實驗組 | 溫度 | 起始時物質的量/mol | 平衡時物質的量/mol | 達到平衡所需的時間/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650℃ | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900℃ | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650℃ | 1.0 | 4.0 | 2.0 | a | b | c | t |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 肉桂酸是香料、化妝品、醫(yī)藥、塑料和感光樹脂等的重要原料.實驗室用下列反應制取肉桂酸.
肉桂酸是香料、化妝品、醫(yī)藥、塑料和感光樹脂等的重要原料.實驗室用下列反應制取肉桂酸.
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇熱水水解 | 0.04 | 互溶 |
| 沸點(℃) | 179.6 | 138.6 | 300 | 118 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 對于A(s)+2B(g)?3C(g)△H>0,若平衡時C的百分含量跟條件X、Y的關系如圖①所示則Y可能表示溫度,x可能表示壓強,且Y3>Y2>Y1 | |
| B. | 已知可逆反應4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1.若反應物起始物質的量相同,則圖②可表示溫度對NO的百分含量的影響 | |
| C. | 已知反應2A(g)?B(?)+2C(?);△H=+QKJ/mol(Q>0),滿足如圖③所示的關系,則B、C可能均為氣體 | |
| D. | 圖④是恒溫下某化學反應的反應速率隨反應時間變化的示意圖,則該反應的正反應是一個氣體體積增大的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com