
科目: 來源: 題型:實驗題
| 化學鍵 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | x | 465 | 413 |

查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 前10min反應的平均速率v(C)=0.1 mol/(L•min) | |
| B. | 反應達到平衡時B的平衡濃度是1.5 mol•L-1 | |
| C. | 恒溫下,將反應容器體積壓縮為原來的一半,則D的平衡濃度小于1.0 mol•L-1 | |
| D. | 10 min后在容器中加入A,重新建立平衡時A的轉化率一定大于50% |
查看答案和解析>>
科目: 來源: 題型:實驗題
| 溫度℃ | 450 | 500 | 550 | 600 |
| SO2的轉化率% | 97.5 | 95.8 | 90.50 | 80.0 |
查看答案和解析>>
科目: 來源: 題型:實驗題
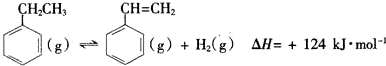
| 化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | x | 436 |
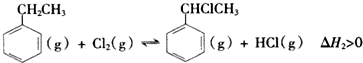
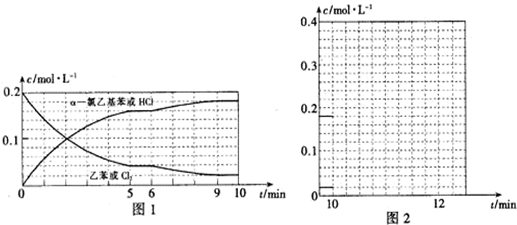
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
| T/K | 298 | 398 | 498 |
| 平衡常數K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目: 來源: 題型:解答題
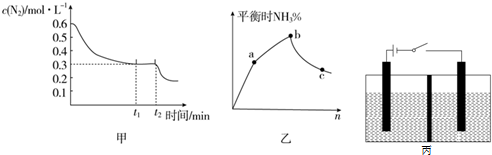
查看答案和解析>>
科目: 來源: 題型:解答題
 二甲醚(CH3OCH3)是一種應用前景廣闊的清潔燃料,以CO和H2為原料生產二甲醚主要發生以下三個反應:
二甲醚(CH3OCH3)是一種應用前景廣闊的清潔燃料,以CO和H2為原料生產二甲醚主要發生以下三個反應:| 編號 | 熱化學方程式 | 化學平衡常數 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
| 化學鍵 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| 壓強/MPa | 10 | 20 | 30 | 40 |
| φ(NH3) | 0.30 | 0.45 | 0.54 | 0.60 |
| A. | 10 MPa時,H2的轉化率為75% | |
| B. | 20 MPa時,NH3的物質的量濃度是10 MPa時的1.5倍 | |
| C. | 40 MPa時,若容器的體積為VL,則平衡常數$K=\frac{{64{V^2}}}{3}$ | |
| D. | 30 MPa時,若向容器中充入惰性氣體,則平衡向正反應方向移動 |
查看答案和解析>>
科目: 來源: 題型:解答題

| 實驗編號 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com