
| 壓強/MPa | 10 | 20 | 30 | 40 |
| φ(NH3) | 0.30 | 0.45 | 0.54 | 0.60 |
| A. | 10 MPa時,H2的轉化率為75% | |
| B. | 20 MPa時,NH3的物質的量濃度是10 MPa時的1.5倍 | |
| C. | 40 MPa時,若容器的體積為VL,則平衡常數$K=\frac{{64{V^2}}}{3}$ | |
| D. | 30 MPa時,若向容器中充入惰性氣體,則平衡向正反應方向移動 |
分析 1molN2和3mol H2充入體積可變的恒溫密閉容器中,溫度、壓強不變,則物質的量與體積成正比,
A.10 MPa時,設轉化的氫氣為xmol,則
N2(g)+3H2(g)$\stackrel{催化劑}{?}$2NH3
開始 1 3 0
轉化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$×100%=0.3,解得x=0.461mol;
B.20 MPa時,設轉化的氫氣為ymol,則
N2(g)+3H2(g)$\stackrel{催化劑}{?}$2NH3
開始 1 3 0
轉化 y 3y 2y
平衡 1-y 3-3y 2y
$\frac{2y}{1-y+3-3y+2y}$×100%=0.45,解得y=0.621mol;
C.40 MPa時,設轉化的氫氣為zmol,則
N2(g)+3H2(g)$\stackrel{催化劑}{?}$2NH3
開始 1 3 0
轉化 z 3z 2z
平衡 1-z 3-3z 2z
$\frac{2z}{4-2z}$×100%=0.60,解得z=0.75,結合平衡濃度計算K;
D.30 MPa時,若向容器中充入惰性氣體,體積增大,則壓強減小.
解答 解:1molN2和3mol H2充入體積可變的恒溫密閉容器中,溫度、壓強不變,則物質的量與體積成正比,
A.10 MPa時,設轉化的氫氣為xmol,則
N2(g)+3H2(g)$\stackrel{催化劑}{?}$2NH3
開始 1 3 0
轉化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$×100%=0.3,解得x=0.461mol,則H2的轉化率為$\frac{0.461mol}{1mol}$×100%=46.1%,故A錯誤;
B.20 MPa時,設轉化的氫氣為ymol,則
N2(g)+3H2(g)$\stackrel{催化劑}{?}$2NH3
開始 1 3 0
轉化 y 3y 2y
平衡 1-y 3-3y 2y
$\frac{2y}{1-y+3-3y+2y}$×100%=0.45,解得y=0.621mol,則氨氣的物質的量不是10MPa時的1.5倍,即NH3的物質的量濃度不是10 MPa時的1.5倍,故B錯誤;
C.40 MPa時,設轉化的氫氣為zmol,則
N2(g)+3H2(g)$\stackrel{催化劑}{?}$2NH3
開始 1 3 0
轉化 z 3z 2z
平衡 1-z 3-3z 2z
$\frac{2z}{4-2z}$×100%=0.60,解得z=0.75,
若容器的體積為VL,則平衡常數K=$\frac{(\frac{1.5}{V})^{2}}{\frac{0.25}{V}×(\frac{0.75}{V})^{3}}$=$\frac{64{V}^{2}}{3}$,故C正確;
D.30 MPa時,若向容器中充入惰性氣體,體積增大,則壓強減小,則合成氨的反應逆向移動,故D錯誤;
故選C.
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法、體積與物質的量的關系為解答的關鍵,側重分析與計算能力的考查,注意選項B為解答的難點,題目難度不大.


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 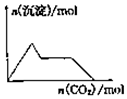 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中緩慢通入CO2至過量 | |
| B. | 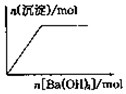 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至過量 | |
| C. | 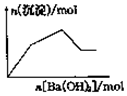 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至過量 | |
| D. | 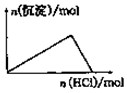 向NaAlO2溶液中逐滴加入鹽酸至過量 |
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:選擇題
某同學組裝了如圖所示的電化學裝置,其中電極I為Al,其它均為Cu,下列說法正確的是( )
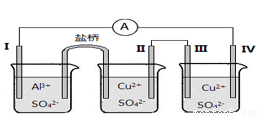
A.裝Al2(SO4)3 溶液的燒杯是原電池,其余兩個為電解(電鍍)池
B.鹽橋中電子從右側流向左側
C.電極II逐漸溶解
D.電極IV的電極反應:Cu2+ + 2e- = Cu
查看答案和解析>>
科目:高中化學 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:選擇題
下列實驗操作、現象及由此得出的結論均正確的是
選項 | 實驗操作 | 現象 | 結論 |
A | 將銅粉加入1.0 mol·L-1Fe2(SO4)3溶液中 | 銅粉溶解 | 金屬銅比鐵活潑 |
B | 將pH試紙放在玻片上,用玻璃棒蘸取某新制氯水,點在pH試紙中央,與標準比色卡對照 | pH=2 | 氯氣與水反應生成了強酸 |
C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再調溶液的pH約為5 | 有紅褐色沉淀生成 | Fe2+被H2O2氧化為Fe3+ |
D | 將KI和FeCl3溶液在試管中混合后,加入汽油,振蕩,靜置 | 下層溶液顯紫紅色 | 生成的I2全部溶于汽油中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
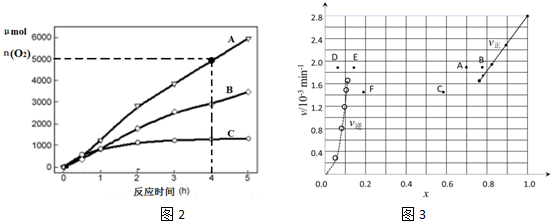
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
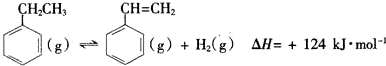
| 化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | x | 436 |
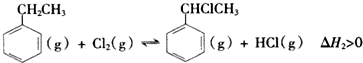
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熔融NaHSO4電離出的陽離子與陰離子之比 | |
| B. | 0.2mol•L-1的CH3COOH溶液與0.1mol•L-1的鹽酸中c(H+)之比 | |
| C. | pH=7的氨水與(NH4)2SO4的混合溶液中,c(NH4+)與c(SO42-)之比 | |
| D. | pH=12的Ba(OH)2溶液與pH=12的KOH溶液中c(OH-)之比 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 或
或 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com