

| 實驗編號 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
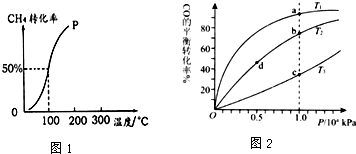
分析 (1)①根據圖知道平衡時甲烷的轉化率,求出△c(CH4),根據v=$\frac{△c}{△t}$計算v(CH4),利用速率之比等于化學計量數之比計算v(H2).
②根據定一議二原則,定溫度同,再比較壓強,即作垂直x軸的輔助線,比較平衡時甲烷的轉化率,由此判斷;
平衡常數k=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$,計算出平衡時,各組分的濃度,代入平衡常數計算.
③由圖可知,溫度越高甲烷的轉化率越大,即升高溫度平衡向正反應方向移.
(2)①容器容積不變,增加甲醇產率,平衡向正反應移動,根據外界條件對平衡的影響分析.
②采取控制變量法,探究合成甲醇的溫度和壓強的適宜條件,據此判斷a、b的值.
③根據定一議二原則,定溫度同,再比較壓強,即作垂直x軸的輔助線,比較平衡時CO的轉化率,由此判斷.
解答 解:(1)①由圖知道平衡時甲烷的轉化率為0.5,所以△c(CH4)=$\frac{1.0mol×0.5}{100L}$=0.005mol/L,
所以v(CH4)=$\frac{0.005mol/L}{5min}$=0.001mol/(L•min),速率之比等于化學計量數之比,所以v(H2)=3v(CH4)=3×0.001mol/(L•min)=0.003mol/(L•min).
故答案為:0.003mol/(L•min).
②溫度相同時,作垂直x軸的輔助線,發現壓強為P1的CH4的轉化率高,反應為前后體積增大的反應,壓強增大平衡向體積減小的方向移動,即向逆反應移動,CH4的轉化率降低,所以P1<P2.
CH4(g)+H2O(g)?CO(g)+3H2(g),
開始(mol):1.0 2.0 0 0
變化(mol):1.0×0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
所以平衡常數k=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$=$\frac{\frac{0.5mol}{100L}×(\frac{1.5mol}{100L})^{3}}{\frac{0.5mol}{100L}×\frac{1.5mol}{100L}}$=2.25×10-4,
故答案為:<;2.25×10-4
③由圖可知,溫度越高甲烷的轉化率越大,即升高溫度平衡向正反應方向移,溫度升高平衡向吸熱方向移動,所以正反應為吸熱反應,即△H>0.
故答案為:>
(2)①A、該反應為放熱反應,升高溫度,平衡向吸熱方向移動,即向逆反應方向移動,甲醇的產率降低,故A錯誤;
B、將CH3OH(g)從體系中分離,產物的濃度降低,平衡向正反應移動,甲醇的產率增加,故B錯誤;
C、充入He,使體系總壓強增大,容器容積不變,反應混合物各組分濃度不變,平衡不移動,甲醇的產率不變,故C錯誤;
D、再充入1mol CO和3mol H2,可等效為壓強增大,平衡向體積減小的方向移動,即向正反應方向移動,甲醇的產率增加,故D正確.
故選:BD,
故答案為:BD;
②A、采取控制變量法,探究合成甲醇的溫度和壓強的適宜條件,所以溫度、壓強是變化的,$\frac{n(CO)}{n({H}_{2})}$應保持不變,所以b=$\frac{1}{3}$;比較使用1、2,壓強不同,所以溫度應相同,故a=150.
故答案為:a=150;b=$\frac{1}{3}$;
B、溫度相同時,作垂直x軸的輔助線,發現壓強為Py的CO的轉化率高,反應為前后體積減小的反應,壓強增大平衡向體積減小的方向移動,即向正反應移動,所以Px<Py,所以壓強Px=0.1MPa.
故答案為:0.1
點評 本題考查化學反應速率、平衡常數、化學平衡計算、化學平衡的影響因素及讀圖能力等,綜合性較大,難度中等,知識面廣,應加強平時知識的積累.注意控制變量法與定一議二原則應用.


科目:高中化學 來源:2016-2017學年甘肅省高二上10月月考化學試卷(解析版) 題型:選擇題
0.1mol/L NH4Cl溶液中,下列敘述錯誤的是 ( )
A.c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.c(Cl—)>c(NH4+)>c(H+)>c(OH—)
C.c(NH4+)+c(H+)=c(Cl—)+c(OH—)
D.c(NH4+)+c(NH3 ·H2O)=c(Cl—)
·H2O)=c(Cl—)
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:選擇題
常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.加入鋁粉能產生氫氣的溶液:Mg2+、K+、Br-、HCO3-
B.滴入石蕊顯紅色的溶液:Na+、K+、S2-、NO3-
C.pH = 14的溶液中:Na+、AlO2-、SO42-、Cl-
D.滴入KSCN溶液顯紅色的溶液中:Ca2+、H+、I-、Cl-
查看答案和解析>>
科目:高中化學 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:填空題
查閱資料:元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)4?(綠色)、Cr2O72?(橙紅色)、CrO42?(黃色)等形式存在,Cr(OH)3為難溶于水的灰藍色固體,回答下列問題:
(1)鉻(24Cr)屬于_______________(選填編號)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.過渡元素
(2)鉻單質是銀白色有金屬光澤的固體,有較高的熔點,是最硬的金屬;與Ni等添加到Fe中可制成不銹鋼。比較硬度:純鐵_________不銹鋼;熔點:純鐵__________不銹鋼(填“>”“<”或“=”)。
(3)Cr(OH)3與Al(OH)3的化學性質相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至過量,可觀察到的現象是___________________。
(4)CrO42?和Cr2O72?在溶液中可相互轉化。室溫下,初始濃度為1.0 mol·L?1的Na2CrO4溶液中c(Cr2O72?)隨c(H+)的變化如圖所示。
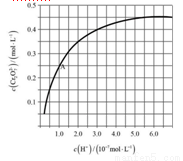
①用離子方程式表示Na2CrO4溶液中的轉化反應____________________。
②由圖可知,溶液酸性增大,CrO42?的平衡轉化率__________(填“增大”“減小”或“不變”)。根據A點數據,計算出該轉化反應的平衡常數為__________。
③升高溫度,溶液中CrO42?的平衡轉化率減小,則該反應的ΔH__________0(填“>”“<”或“=”)。
(5)+6價鉻的化合物毒性較大,但其化合物用途廣泛。如:“酒精檢測儀”可檢查司機是否酒駕,其反應原理為:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化學式最有可能為__________。常用NaHSO3將酸性廢液中的Cr2O72?還原成Cr3+,該反應的離子方程式為_______________。
查看答案和解析>>
科目:高中化學 來源:2017屆重慶一中高三上學期第二次月考化學試卷(解析版) 題型:選擇題
材料、能源、信息、環境與化學關系密切,下列說法不正確的是
A.我們使用合金是因為它比純金屬具有更優良的機械性能
B.鋼化玻璃、有機玻璃、石英玻璃均屬于硅酸鹽材料
C.高鐵酸鉀(K2FeO4)是一種新型、高效、多功能水處理劑,既能殺菌消毒又能凈水
D.高純度的二氧化硅廣泛用于制作光導纖維,光導纖維遇強堿會“斷路”
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | HClO═H++ClO- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com