
科目: 來源: 題型:實驗題
| 溫度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常數(shù)K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
| n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
| n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
| n(H2O)/mol | 5 | 2 | 2 | 2 |
查看答案和解析>>
科目: 來源: 題型:實驗題
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 編號 | C(H2)mol/L | C(CO)mol/L |
| 甲 | 2 | 1 |
| 乙 | 1 | 2 |
| 丙 | 1 | 1 |
查看答案和解析>>
科目: 來源: 題型:解答題
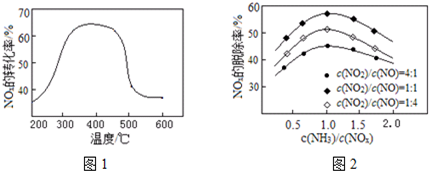
查看答案和解析>>
科目: 來源: 題型:解答題
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

查看答案和解析>>
科目: 來源: 題型:解答題
| 反應過程 | 化學方程式 | 不同溫度下的K | ||
| 273.15K | 1000K | |||
| Ⅰ | 二甲醚羰基化反應 | CH3OCH3(g)+CO(g)?CH3COOCH3(g) | 1016.25 | 101.58 |
| Ⅱ | 乙酸甲酯加氫反應 | CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g) | 103.97 | 10-0.35 |
| 時間(min) 濃度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| CH3OCH3(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CO(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CH3COOCH3(g) | 0 | 0.20 | 0.30 | 1.00 | 1.50 | 1.50 |

查看答案和解析>>
科目: 來源: 題型:解答題
 甲醇是一種可再生能源,具有廣泛的開發(fā)和應用前景.工業(yè)上一般采用下列反應合成甲醇CO(g)+2H2(g)?CH3OH(g)△H
甲醇是一種可再生能源,具有廣泛的開發(fā)和應用前景.工業(yè)上一般采用下列反應合成甲醇CO(g)+2H2(g)?CH3OH(g)△H| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 3.041 | 1.000 | 0.120 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小蘇打治療胃酸過多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氫鈉溶液與少量石灰水反應:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向澄清石灰水中通入過量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 通過電泳實驗證明膠體帶電 | |
| B. | 通常利用丁達爾效應區(qū)別溶液與膠體 | |
| C. | 過濾實驗說明膠體粒子不能透過濾紙 | |
| D. | 向煮沸的NaOH溶液中滴加FeCl3溶液可制備Fe(OH)3膠體 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 鐵鋁礬有凈水作用,其水溶液顯中性 | |
| B. | 向該溶液中加入Na2S溶液,有淡黃色沉淀 | |
| C. | 用惰性電極電解該溶液時,陰極區(qū)有沉淀 | |
| D. | 在空氣中,蒸干并灼燒該溶液,最后所得的殘留固體為Al2O3、Fe2O3 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com