
| 反應過程 | 化學方程式 | 不同溫度下的K | ||
| 273.15K | 1000K | |||
| Ⅰ | 二甲醚羰基化反應 | CH3OCH3(g)+CO(g)?CH3COOCH3(g) | 1016.25 | 101.58 |
| Ⅱ | 乙酸甲酯加氫反應 | CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g) | 103.97 | 10-0.35 |
| 時間(min) 濃度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| CH3OCH3(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CO(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CH3COOCH3(g) | 0 | 0.20 | 0.30 | 1.00 | 1.50 | 1.50 |

分析 (1)二甲醚羰基化反應為CH3OCH3(g)+CO(g)?CH3COOCH3(g),根據表中數據可知,溫度從273.15K升高到1000K,該反應的平衡常數從1016.25變為101.58,升高溫度后平衡常數減小,則升高溫度平衡向著逆向移動,據此判斷該反應的焓變;
(2)CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g),反應為氣體體積減小的放熱反應,可逆反應達到平衡狀態時,各物質的物質的量、物質的量濃度及各物質成分都不變,以及由此引起的一系列物理量不變;
(3)平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$,反應為放熱反應,升溫平衡逆向進行;
(4)圖象分析可知乙酸甲酯含量在300K~600K范圍內,隨溫度升高增大,反應Ⅰ的轉化率增大,反應Ⅱ的轉化率小;
(5)①CH3OCH3(g)+CO(g)?CH3COOCH3(g)△H<0,20min時到30min,CH3OCH3(g)和CO(g)物質的量難度減小0.7mol/L,生成的CH3COOCH3(g)物質的量難度增加0.7mool/L,和10min-20min內反應的變化可知反應速率增加,但反應比例關系符合化學方程式計量數之比,說明是加入了催化劑;
②圖表中數據可知,20min后反應速率增大,是加入了催化劑,圖象中變化快,40min反應達到平衡狀態,此時乙酸甲酯體積含量=$\frac{1.5}{0.5+0.5+1.5}$×100%=60%,40min后含量不再發生變化,據此畫出圖象.
解答 解:(1)根據表中數據可知,溫度從273.15K升高到1000K,反應CH3OCH3(g)+CO(g)?CH3COOCH3(g)的平衡常數從1016.25變為101.58,升高溫度平衡常數減小,則升高溫度平衡向著逆向移動,說明逆反應為吸熱反應,則正反應為放熱反應,所以該反應的焓變△H<0,
故答案為:<;
(2)CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g),反應為氣體體積減小的放熱反應,
A.速率之比等于化學方程式計量數之比,2v(CH3COOCH3)=v(H2)為正反應速率之比,不能證明反應達到平衡狀態,故A錯誤;
B.反應前后氣體體積減小的放熱反應,密閉容器中總壓強不變說明物質的物質的量不變,說明反應達到平衡狀態,故B正確;
C.氣體質量和體積不變,密閉容器中混合氣體的密度保持不變不能說明反應達到平衡狀態,故C錯誤;
D.密閉容器中C2H5OH的體積分數保持不變說明反應達到平衡,故D正確;
故答案為:BD;
(3)CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g)的平衡常數表達式K=$\frac{c({C}_{2}{H}_{5}OH)c(C{H}_{3}OH)}{c(C{H}_{3}OC{H}_{3})c(CO){c}^{2}({H}_{2})}$,反應為放熱反應,隨溫度的升高,平衡逆向進行,總反應的K減小,
故答案為:$\frac{c({C}_{2}{H}_{5}OH)c(C{H}_{3}OH)}{c(C{H}_{3}OC{H}_{3})c(CO){c}^{2}({H}_{2})}$;減小;
(4)觀察圖2可知乙酸甲酯含量在 300K~600K范圍內發生變化是隨溫度升高而增大,該溫度范圍,反應Ⅰ轉化率都很大,反應Ⅱ的轉化率隨溫度升高而減小,所以乙酸甲酯的含量升高,
故答案為:隨溫度升高而增大;該溫度范圍,反應Ⅰ轉化率都很大,反應Ⅱ的轉化率隨溫度升高而減小,所以乙酸甲酯的含量升高;
(5)①CH3OCH3(g)+CO(g)?CH3COOCH3(g)△H<0,20min時到30min,CH3OCH3(g)和CO(g)物質的量難度減小0.7mol/L,生成的CH3COOCH3(g)物質的量難度增加0.7mool/L,和10min-20min內反應的變化可知,轉化率與20min時到30min的轉化率相同,反應速率增加,反應比例關系符合化學方程式計量數之比,反應物的轉化率未變,說明是加入了催化劑,
A.通入一定量的CO 會提高 CH3OCH3(g)的轉化率,CO轉化率減小,不符合表中數據變化,故A錯誤;
B.移出一定量的CH3OCH3 會提高,故B錯誤;
C.加入合適的催化劑會提高反應速率,不改變反應物的轉化率,故C正確;
故答案為:C;
②圖表中數據可知,20min后反應速率增大,是加入了催化劑,圖象中變化快,40min反應達到平衡狀態,此時乙酸甲酯體積含量=$\frac{1.5}{0.5+0.5+1.5}$×100%=60%,40min后含量不再發生變化,畫出的圖象為: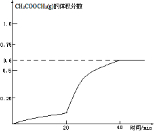 ,
,
故答案為: .
.
點評 本題考查了反應熱與焓變的關系、化學平衡影響因素、平衡常數計算、平衡狀態的建立等,題目難度中等,明確化學反應與能量變化的關系為解答關鍵,注意掌握吸熱反應、放熱反應與焓變之間關系,試題培養了學生的分析能力及靈活應用基礎知識的能力


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
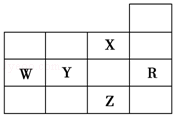 如圖為元素周期表前四周期的一部分,下列有關R、W、X、Y、Z五種元素的敘述中,正確的是( )
如圖為元素周期表前四周期的一部分,下列有關R、W、X、Y、Z五種元素的敘述中,正確的是( )| A. | W元素的電負性大于Y元素的電負性 | |
| B. | X元素是電負性最大的元素 | |
| C. | p能級未成對電子最多的是Z元素 | |
| D. | Y、Z的陰離子電子層結構都與R原子的相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵鋁礬有凈水作用,其水溶液顯中性 | |
| B. | 向該溶液中加入Na2S溶液,有淡黃色沉淀 | |
| C. | 用惰性電極電解該溶液時,陰極區有沉淀 | |
| D. | 在空氣中,蒸干并灼燒該溶液,最后所得的殘留固體為Al2O3、Fe2O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿式滴定管用蒸餾水洗滌之后裝入KOH標準溶液,并讀數 | |
| B. | 選擇酚酞作指示劑,終點時溶液由無色剛好變成粉紅色且半分鐘不褪色 | |
| C. | 錐形瓶中從滴定開始到滴定終點時,水電離的c(H+)由小逐漸增大 | |
| D. | 滴定終點時,發現滴定管尖嘴處有氣泡,則測定結果偏低 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
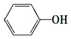 苯酚具有弱酸性,其Ka=1.1×10-10;水楊酸第一級電離形成的
苯酚具有弱酸性,其Ka=1.1×10-10;水楊酸第一級電離形成的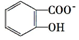
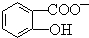 中形成分子內氫鍵,使其更難電離出H+.
中形成分子內氫鍵,使其更難電離出H+.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com