
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
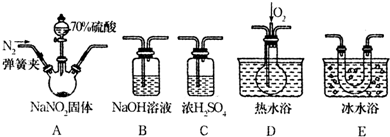
查看答案和解析>>
科目: 來源: 題型:解答題
| 酸 | 電離平衡常數K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 在1 mol CaC2、KHSO4的混合物中含陰、陽離子的總數為3NA | |
| B. | 0.1 mol C2H5OH中所含C-H鍵的數目為0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子數一定為0.2NA | |
| D. | 78gNa2O2與足量水反應轉移的電子數為2NA |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| a | b | c | |
| A | 2 | 1 | 1 |
| B | 1 | 1 | 0 |
| C | 1 | 0 | 1 |
| D | 0 | 1 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 來源: 題型:解答題
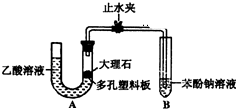 某校學生小組為探究乙酸、碳酸和苯酚的酸性強弱并證明乙酸為弱酸,進行下述實驗.探究乙酸、碳酸和苯酚的酸性強弱關系該校學生設計了如圖的實驗裝置(夾持儀器已略去).
某校學生小組為探究乙酸、碳酸和苯酚的酸性強弱并證明乙酸為弱酸,進行下述實驗.探究乙酸、碳酸和苯酚的酸性強弱關系該校學生設計了如圖的實驗裝置(夾持儀器已略去). -ONa溶液的pH,其pH由大到小排列的順序為bdac (填溶液編號)
-ONa溶液的pH,其pH由大到小排列的順序為bdac (填溶液編號)查看答案和解析>>
科目: 來源:2016-2017學年江西省高二上第一次月考化學卷(解析版) 題型:填空題
用Cl2生產某些含氯有機物時會產生副產物HC1。利用 反應A,可實現氯的循環利用。
反應A,可實現氯的循環利用。
反應A:4HCl+O22Cl2+2H2O
(1)已知:Ⅰ、反應A中, 4mol HCl被氧化,放出115.6kJ的熱量。
4mol HCl被氧化,放出115.6kJ的熱量。
Ⅱ、
①反應A的熱化學方程式是________________________。
②斷開1 mol H—O 鍵與斷開 1 mol H—Cl 鍵所需能量相差約為__________kJ,H2O中H—0 鍵比HCl中H—Cl鍵(填“強”或“弱”)_______________。
(2)合成氨工廠常通過測定反應前后混合氣體的密度來確定氨的轉化率。某工廠測得合成塔中N2、H2混合氣體的密度為0.5536g/L(標準狀況),從合成塔中出來的混合氣體在相同條件下密度為0.693g/L(標準狀況)。該合成氨廠N2的轉化率為___________。
查看答案和解析>>
科目: 來源: 題型:選擇題
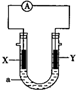
| A. | X為負極,電極反應為:Al-3e-═Al3+ | |
| B. | X為正極,電極反應為:2H2O+O2+4e-═4OH- | |
| C. | Y為負極,電極反應為:Mg-2e-═Mg2+ | |
| D. | Y為正極,電極反應為:2H2O+2e-═2OH-+H2↑ |
查看答案和解析>>
科目: 來源: 題型:填空題
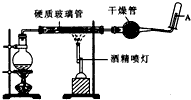 在常溫下,Fe與水并不起反應,但在高溫下,Fe與水蒸氣可發生反應. 應用下列裝置,在硬質玻璃管中放入還原鐵粉和石棉絨的混合物,加熱,并通入水蒸氣,就可以完成高溫下“Fe與水蒸氣的反應實驗”. 請回答該實驗中的問題.
在常溫下,Fe與水并不起反應,但在高溫下,Fe與水蒸氣可發生反應. 應用下列裝置,在硬質玻璃管中放入還原鐵粉和石棉絨的混合物,加熱,并通入水蒸氣,就可以完成高溫下“Fe與水蒸氣的反應實驗”. 請回答該實驗中的問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com