
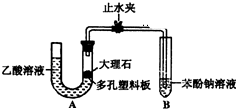
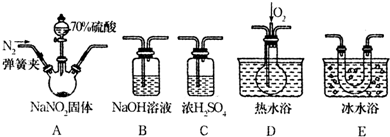
 某校學生小組為探究乙酸、碳酸和苯酚的酸性強弱并證明乙酸為弱酸,進行下述實驗.探究乙酸、碳酸和苯酚的酸性強弱關系該校學生設計了如圖的實驗裝置(夾持儀器已略去).
某校學生小組為探究乙酸、碳酸和苯酚的酸性強弱并證明乙酸為弱酸,進行下述實驗.探究乙酸、碳酸和苯酚的酸性強弱關系該校學生設計了如圖的實驗裝置(夾持儀器已略去). -ONa溶液的pH,其pH由大到小排列的順序為bdac (填溶液編號)
-ONa溶液的pH,其pH由大到小排列的順序為bdac (填溶液編號) 分析 (1)根據體系內產生的壓強是否變化來判斷裝置的氣密性,碳酸鈣和醋酸反應生成醋酸鈣和水、二氧化碳;
(2)二氧化碳和苯酚鈉反應生成不易溶于水的苯酚和碳酸氫鈉,根據離子方程式的書寫規則書寫;
(3)要防止醋酸干擾實驗,在氣態未和苯酚反應前將其除去,可選用飽和的碳酸氫鈉溶液除去醋酸且又不引進新的雜質氣體;
(4)證明乙酸為弱酸需證明溶液中存在電離平衡,依據提供的試劑可以對溶液稀釋測定溶液PH的變化分析判斷是否存在電離平衡分析設計;
(5)都是強堿弱酸鹽,溶液顯示堿性,酸根離子對應的酸的酸性越弱,水解程度越大,溶液的pH越大,據此進行判斷各溶液的pH大小.
解答 解:(1)U型管兩側液面差能產生壓強,所以能判斷裝置的氣密性,故正確;碳酸鈣和醋酸反應生成醋酸鈣和水、二氧化碳,反應方程式為CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O,
故答案為:正確;CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O;
(2)二氧化碳和苯酚鈉反應生成不易溶于水的苯酚和碳酸氫鈉,所以看到的現象是溶液出現渾濁,反應離子方程式為:C6H5O-+CO2+H2O→C6H5OH+HCO3-,
故答案為:試管中溶液出現渾濁;C6H5O-+CO2+H2O→C6H5OH+HCO3-;
(3)要防止醋酸干擾實驗,在氣態未和苯酚反應前將其除去,可選用飽和的碳酸氫鈉溶液除去醋酸且又不引進新的雜質氣體,所以在裝置A和B之間連一個盛有飽和碳酸氫鈉溶液的洗氣瓶除去醋酸,
故答案為:在裝置A和B之間連一個盛有飽和碳酸氫鈉溶液的洗氣瓶;
(4)明乙酸為弱酸需證明溶液中存在電離平衡,依據提供的試劑可以對溶液稀釋測定溶液PH的變化,實驗步驟為:取pH=3的乙酸溶液加入蒸餾水稀釋100倍,用pH試紙測定溶液的pH小于5,
故答案為:用量筒量取一定體積的乙酸溶液,加蒸餾水稀釋100倍,用pH試紙測其pH,pH<5,則證明乙酸是弱酸(或其他合理答案);
(5)a.NaHCO3溶液 b.Na2CO3溶液 c.CH3COONa溶液 d. -ONa,以上都是強堿弱酸鹽,溶液都顯示堿性,化學式中含有的弱酸根離子對應的酸的酸性越強,其水解程度越弱,溶液的pH越小,而酸性關系為:醋酸>碳酸>苯酚>碳酸氫根離子,則以上溶液的pH由大到小排列的順序為bdac,
-ONa,以上都是強堿弱酸鹽,溶液都顯示堿性,化學式中含有的弱酸根離子對應的酸的酸性越強,其水解程度越弱,溶液的pH越小,而酸性關系為:醋酸>碳酸>苯酚>碳酸氫根離子,則以上溶液的pH由大到小排列的順序為bdac,
故答案為:bdac.
點評 本題考查了比較弱酸酸性強弱的方法、證明弱電解質的方法,題目難度中等,注意掌握比較弱電解質酸性強弱常用的方法,明確判斷鹽的水解程度的方法:越弱越水解.


科目:高中化學 來源: 題型:解答題
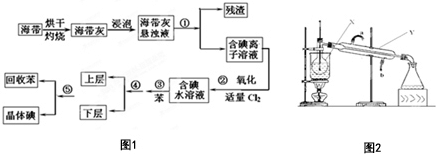 海洋植物如海帶中含有豐富的碘元素,碘元素以碘離子的形式存在.實驗室從海帶中提取碘的流程圖如圖1:(已知:Cl2+2I-═2Cl-+I2)
海洋植物如海帶中含有豐富的碘元素,碘元素以碘離子的形式存在.實驗室從海帶中提取碘的流程圖如圖1:(已知:Cl2+2I-═2Cl-+I2) 查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 納米級Cu2O由于具有優良的催化性能而受到關注,下表為制取CuO2的三種方法:
納米級Cu2O由于具有優良的催化性能而受到關注,下表為制取CuO2的三種方法:| 方法Ⅰ | 用炭粉在高溫條件下還原CuO |
| 方法Ⅱ | 電解法:2Cu+H2O$\frac{\underline{\;電解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)還原新制Cu(OH)2 |
| 序號 | 溫度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
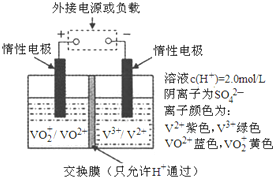 釩(V)及其化合物廣泛應用于工業催化、新材料和新能源等領域.
釩(V)及其化合物廣泛應用于工業催化、新材料和新能源等領域.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com