
科目: 來源: 題型:解答題
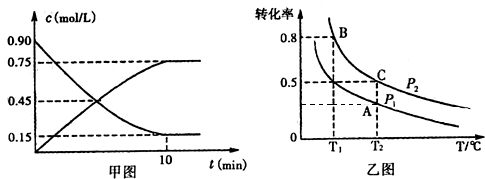
| NH3•H2O | H2SO3 | ||
| 電離平衡常數(mol/L) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 | ||
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 風能是人類通過風車等工具獲取的能源,屬于一次能源 | |
| B. | 在即將到來的新能源時代,核能、太陽能、氫能將成為主要能源 | |
| C. | 在一個確定的化學反應中,反應物的總能量與生成物的總能量一定不同 | |
| D. | 原電池將把化學能直接轉化為電能,所以由原電池提供的電能是一次能源 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
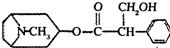
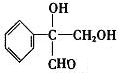 或
或 ;
;查看答案和解析>>
科目: 來源: 題型:解答題
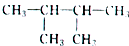 的系統命名為2,3-二甲基丁烷;
的系統命名為2,3-二甲基丁烷;查看答案和解析>>
科目: 來源: 題型:選擇題
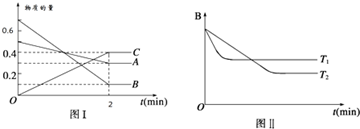
| A. | 2min內A的化學反應速率為0.1 mol/(L•min) | |
| B. | 在反應達平衡時,保持其他條件不變,增大壓強,正逆反應速率都增大,且平衡向逆反應方向移動 | |
| C. | 在反應達平衡時,其他條件不變,升高溫度,正逆反應速率都增大,且A的轉化率增大 | |
| D. | 圖(I)中,達平衡時,A的體積分數為37.5% |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
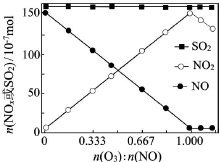 煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:
煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:查看答案和解析>>
科目: 來源: 題型:解答題
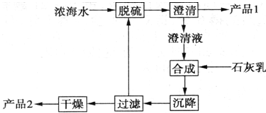 將海水淡化與濃縮海水資源化結合起來是綜合利用海水的重要途徑之一.一般是先將海水淡化獲得淡水,再從剩余的濃縮海水中通過一系列工藝流程提取其他產品.
將海水淡化與濃縮海水資源化結合起來是綜合利用海水的重要途徑之一.一般是先將海水淡化獲得淡水,再從剩余的濃縮海水中通過一系列工藝流程提取其他產品.| 離子 | Na+ | Mg2+ | Cl- | SO42- |
| 濃度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com