

分析 (1)使濕潤的紅色石蕊試紙變藍的氣體為氨氣,由圖1得知:溫度越高,肼的百分含量越低,即分解的越快;
(2)①反應Ⅰ:N2H4(g)?N2(g)+2H2(g)△H1,反應是分解反應屬于吸熱反應;
②依據蓋斯定律和熱化學方程式計算得到3N2H4(g)?2NH3(g)+2N2(g)+3H2(g)的△H;
③反應在4min時達到平衡,比值為3.0,結合化學平衡三行計算列式計算,設分解的肼物質的量濃度為x,
N2H4(g)?N2(g)+2H2(g)
起始量 0.1 0 0
變化量 x x 2x
平衡量 0.1-x x 2x
$\frac{n({N}_{2})+n({H}_{2})}{n({N}_{2}{H}_{4})}$等于其濃度之比=$\frac{x+2x}{0.1-x}$=3.0
x=0.05mol/L,反應速率V=$\frac{△c}{△t}$,平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
(3)①燃料電池是燃料做負極失電子發生氧化反應,氧氣在正極得到電子發生還原反應;
②用此電池進行電鍍銅,開始時電鍍槽中兩極質量相等,依據電子守恒和電極反應計算;
解答 解:(1)使濕潤的紅色石蕊試紙變藍的氣體為氨氣,即肼分解生成氨氣,依據元素守恒得知另外一種產物為氮氣,故化學反應方程式為:3N2H4$\frac{\underline{催化劑}}{△}$N2+4NH3,由圖1可知,溫度越高,肼的體積分數含量越低,故要抑制肼的分解,應降低反應溫度,故答案為:3N2H4$\frac{\underline{催化劑}}{△}$N2+4NH3;降低反應溫度;
(2)①反應Ⅰ:N2H4(g)?N2(g)+2H2(g)△H1,反應是分解反應屬于吸熱反應,△H1>0,
故答案為:>;
②反應Ⅰ:N2H4(g)?N2(g)+2H2(g)△H1
反應Ⅱ:N2(g)+3H2(g)?2NH3(g)△H2
依據蓋斯定律和熱化學方程式計算,Ⅰ×3+Ⅱ×2得到3N2H4(g)?2NH3(g)+2N2(g)+3H2(g)△H=3△H1 +2△H2,
故答案為:3△H1 +2△H2;
③反應在4min時達到平衡,比值為3.0,結合化學平衡三行計算列式計算,設分解的肼物質的量濃度為x,
N2H4(g)?N2(g)+2H2(g)
起始量 0.1 0 0
變化量 x x 2x
平衡量 0.1-x x 2x
$\frac{n({N}_{2})+n({H}_{2})}{n({N}_{2}{H}_{4})}$等于其濃度之比=$\frac{x+2x}{0.1-x}$=3.0
x=0.05mol/L,
反應速率V=$\frac{△c}{△t}$=$\frac{2×0.05mol/L}{4min}$=0.025mol/L•min,
平衡常數K=$\frac{(2×0.05)^{2}×0.05}{0.1-0.05}$=0.01,
故答案為:0.025mol/L•min,0.01;
(3)①N2H4可用于制備燃料電池,通入空氣的電極為原電池的正極,通N2H4的電極為原電池負極,堿性介質中的電極反應為:N2H4-4e-+4OH-=N2+4H2O,
故答案為:正極,N2H4-4e-+4OH-=N2+4H2O;
②用此電池進行電鍍銅,開始時電鍍槽中兩極質量相等,當兩極質量相差1.28g時,物質的量=$\frac{1.28g}{64g/mol}$=0.02mol,Cu-2e-=Cu2+,Cu2++2e-=Cu,電子轉移2mol電子,兩個電極質量相差128g,則當兩極質量相差1.28g時,即物質的量為0.02mol,電子轉移0.02mol,N2H4-4e-+4OH-=N2+4H2O,消耗肼的質量=$\frac{0.02}{4}$mol×32g/mol=0.16g,
故答案為:0.16:
點評 本題考查熱化學方程書寫、化學平衡計算、原電池原理應用等知識點,是對學生綜合能力的考查,關鍵是原電池電解反應、電子守恒的計算,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、K+、HCO3-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | K+、Fe2+、NH4+、NO3- | D. | NH4+、Na+、NO3-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
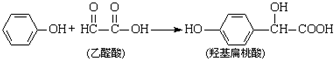
| A. | 該反應是取代反應 | |
| B. | 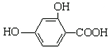 和羥基扁桃酸互為同系物 和羥基扁桃酸互為同系物 | |
| C. | 1個烴基扁桃酸分子中最多有17個原子共平面 | |
| D. | 1mol羥基扁桃酸分子最多能分別和1mol NaHCO3、2mol Na0H、3mol Na、4mol H2發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
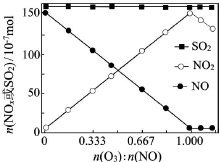 煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:
煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱化學方程式中,如果沒有注明溫度和壓強,則表示反應熱是在標準狀況下測得的數據 | |
| B. | 升高溫度或加入催化劑,不能改變化學反應的反應熱 | |
| C. | 據能量守恒定律,反應物的總能量一定等于生成物的總能量 | |
| D. | 物質發生化學變化不一定伴隨著能量變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-542.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(l)△H=-1059.3 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
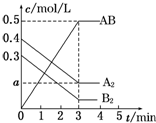 在一個容積為2L的密閉容器中,加入0.8mol A2氣體和0.6mol B2氣體,一定條件下發生如下反應:A2(g)+B2(g)═2AB(g)△H<0,反應中各物質的濃度隨時間的變化情況如圖所示.下列說法正確的是( )
在一個容積為2L的密閉容器中,加入0.8mol A2氣體和0.6mol B2氣體,一定條件下發生如下反應:A2(g)+B2(g)═2AB(g)△H<0,反應中各物質的濃度隨時間的變化情況如圖所示.下列說法正確的是( )| A. | 圖中a點的值為0.05 | B. | 該反應的平衡常數K=0.03 | ||
| C. | 平衡時A2的轉化率為62.5% | D. | 溫度升高,平衡常數K值增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體粒子能夠發生布朗運動而且能產生丁達爾現象 | |
| B. | 膠體粒子帶電荷并且在一定條件下能穩定存在 | |
| C. | 膠體粒子不能穿過半透膜,能通過濾紙空隙 | |
| D. | 膠體的分散質粒子直徑在1nm~100nm之間 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com