
科目: 來源:2016屆寧夏銀川二中高三5月適應性訓練理綜化學試卷(解析版) 題型:填空題
研究NO2、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)已知:2SO2(g)+O2(g)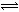 2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)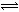 2NO2(g) ΔH=-113.0 kJ·mol—1,則反應:NO2(g)+SO2(g)
2NO2(g) ΔH=-113.0 kJ·mol—1,則反應:NO2(g)+SO2(g)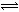 SO3(g)+NO(g)的ΔH= kJ·mol—1
SO3(g)+NO(g)的ΔH= kJ·mol—1
(2)利用反應6NO2+ 8NH3 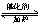 7N2+12H2O可處理NO2。一定條件下,將該反應設計成如右圖所示裝置,其中電極均為石墨,使用熔融金屬氧化物作電解質,寫出負極電極反應式 ;若一段時間內測得外電路中有1.2mol電子通過,則兩極共產生的氣體產物在標準狀況下的體積為 L。
7N2+12H2O可處理NO2。一定條件下,將該反應設計成如右圖所示裝置,其中電極均為石墨,使用熔融金屬氧化物作電解質,寫出負極電極反應式 ;若一段時間內測得外電路中有1.2mol電子通過,則兩極共產生的氣體產物在標準狀況下的體積為 L。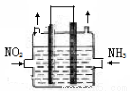
(3)一定條件下,將NO2與SO2以體積比1︰2置于恒容密閉容器中發生下述反應:NO2(g)+SO2(g)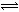 SO3(g)+NO(g),下列能說明該反應達到平衡狀態的是 。
SO3(g)+NO(g),下列能說明該反應達到平衡狀態的是 。
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的物質的量比保持不變 d.每消耗1 mol SO3的同時生成1 molNO2
(4)CO可用于合成甲醇,反應方程式為:CO(g)+2H2(g)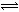 CH3OH(g)。一定溫度下,向容積為2L的密閉容器中充入2molCO和2molH2發生上述
CH3OH(g)。一定溫度下,向容積為2L的密閉容器中充入2molCO和2molH2發生上述 反應,5min后反應平衡,此時測得CH3OH的濃度為0.3mol/L,計算反應開始至平衡時的平均速率v(H2)= ;該溫度下反應的平衡常數為 (保留兩位小數)。
反應,5min后反應平衡,此時測得CH3OH的濃度為0.3mol/L,計算反應開始至平衡時的平均速率v(H2)= ;該溫度下反應的平衡常數為 (保留兩位小數)。
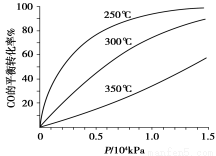
(5)不同溫度CO的平衡轉化率與壓強的關系如上圖所示。該反應ΔH 0(填“>”或“ <”)。實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是 。
查看答案和解析>>
科目: 來源:2016屆寧夏銀川二中高三5月適應性訓練理綜化學試卷(解析版) 題型:實驗題
苯甲酸乙酯(C9H10O2)是一種無色透明液體,不溶于水,稍有水果香味,用于配制香水香精和人造精油,大量用于食品工業中,也可用作有機合成中間體,溶劑等。
(1)其制備方法為:
(2)已知:①
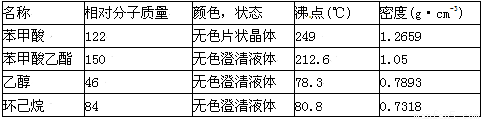
②苯甲酸在100℃會迅速升華
③無水氯化鈣可與乙醇形成難溶于水的CaCl2·6C2H5OH
(3)實驗步驟如下:
① 在儀器A中加入12.20 g苯甲酸,25 mL 9 5%的乙醇(過量),20 mL環己烷以及4 mL濃硫酸,混合均勻并加入沸石,按下圖所示裝好儀器,控制溫度在65~70℃加熱回流2 h。利用分水器不斷分離除去反應生成的水,回流環己烷和乙醇。
5%的乙醇(過量),20 mL環己烷以及4 mL濃硫酸,混合均勻并加入沸石,按下圖所示裝好儀器,控制溫度在65~70℃加熱回流2 h。利用分水器不斷分離除去反應生成的水,回流環己烷和乙醇。
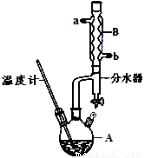
② 反應結束,打開旋塞放出分水器中液體后,關閉旋塞,繼續加熱,至分水器中收集到的液體不再明顯增加,停止加熱。
③ 將儀器A內反應液倒入盛有適量水的燒杯中,分批加入Na2CO3至溶液呈中性。用分液漏斗分出有機層,水層用25 mL乙醚萃取分液,然后合并至有機層,加入氯化鈣,靜置,過濾,將濾液用蒸餾燒瓶進行分餾,低溫蒸出乙醚和環己烷后,繼 續升溫,接收210~213℃的餾分。
續升溫,接收210~213℃的餾分。
④ 檢驗合格,測得產品體積為12.86 mL。回答下列問題:
(1)在該實驗中,儀器A的名稱為 ,其容積最適合的是 (填選項前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)制備苯甲酸乙酯時,最合適的加熱方法是 ,控制溫度的目的是 。加入沸石的作用是 。
(3)步驟①中使用分水器不斷分離除去水的目的是 。
(4)步驟②中應控制餾分的溫度在 。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(5)步驟③有機層應從分液漏斗 (填“上口”或“下口”)流出。加入Na2CO3的作用是 ;若Na2CO3加入不足,在之后蒸餾時,蒸餾燒瓶中可見到白煙生成,產生該現象的原因是 。加入氯化鈣的目的是 。
(6)計算本實驗的產率為 。
查看答案和解析>>
科目: 來源:2016屆寧夏銀川二中高三5月適應性訓練理綜化學試卷(解析版) 題型:實驗題
BaCl2·xH2O是用途廣泛的基礎化工產品。我國目前主要是用鹽酸和硫化鋇(含少量Mg2+、Fe3+等)反應生產BaCl2·xH2O,工藝流程如下圖所示。
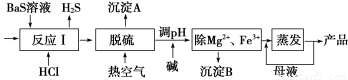
已知:室溫時Ksp[Mg(OH)2]=1.8×10-11 , Ksp[Fe(OH)3]=4.0×10-38 ,請回答下列問題:
(1)反應Ⅰ中生成的H2S用足量氨水吸收,一定條件下向所得溶液中通入空氣,又可得到單質硫并使吸收液再生,再生反應的化學方程式為_____________________________________。
(2)所得氯化鋇粗液中含硫化合物(H2S、HS-等)影響產品質量,可鼓入預熱后的空氣吹除,預熱空氣的目的是_______________;沉淀A的主要成分是_______________。
(3)熱空氣吹除時會有部分HS-轉變為S2O O32-,使產品仍達不到純度要求,可再進行酸化脫硫,酸化脫硫時的離子方程式為______________________________________________________。
(4)室溫時,若加堿調溶液pH調至9,則完全沉淀的離子是__________,另一離子濃度為______mol/L (當溶液中離子濃度小于1×10-5 mol/L時認為該離子完全沉淀) 。若向0.1 mol/L FeCl3溶液中加入一定量等濃度的Na2CO3溶液,出現的現象________,發生反應的離子方程式___________________。
(5)將足量的SO2氣體通入BaCl2溶液中有無明顯現象_____________(填“有”或“無”),向NaOH溶液中通入足量的SO2氣體,寫出所得溶液離子濃度的大小順序________________。
查看答案和解析>>
科目: 來源:2016屆寧夏銀川二中高三5月適應性訓練理綜化學試卷(解析版) 題型:填空題
工業廢渣、廢水回收利用是重要研究課題。下面流程是生產食用香料正丁酸乙酯的工廠廢水(含乙醇、正丁酸乙酯、正丁酸、乙醚和大量無機懸浮物)聯合利用電子工業廢料[含SiO2和Cu2(OH)2CO3]回收銅的工藝設計。回答下列問題:
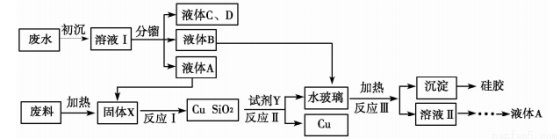
(1)初沉加入的試劑是明礬,寫出參與凈水的離子的水解方程式:______________________。
(2)固體X的成分是__________,反應Ⅰ的化學反應方程式____________________________。
(3)試劑Y為__________,加快反應Ⅱ速率的措施有__________________(任寫一條)。
(4)反應Ⅲ的離子方程式為________________________________________。
(5)硅膠在生活與生產中用途廣泛,寫出其中一種用途:_______________________。
查看答案和解析>>
科目: 來源:2016屆寧夏銀川二中高三5月適應性訓練理綜化學試卷(解析版) 題型:填空題
銅、鐵、鋁都是日常生活中常見的金屬,具有廣泛用途。請回答:
(1)銅元素在元素周期表中位于 ,其原子基態價層電子排布式為 。
(2)Cu2O的熔點比Cu2S的高,原因為 。
(3)Fe(CO)5是一種常見的配合物,可代替四乙基鉛作為汽油的抗爆震劑。
①寫出CO的一種常見等電子體分子的結構式 ;
兩者相比較沸點較高的為 (填分子式)。
②Fe(CO)5在一定條件下發生反應:
Fe(CO)5(s)=Fe(s)+5CO(g),已知:反應過程中,斷裂的化學鍵只有配位鍵,由此判斷該反應所形成的
化學鍵類型為 。
(4)已知AlCl3·NH3有配位鍵。在AlCl3·NH3中,提供空軌道的原子是 ;在NH4+中N原子的雜化軌道類型為 。
(5)金屬鋁的晶胞結構如圖甲所示,原子之間相對位置關系的平面圖如圖乙所示。則晶體鋁中原子的堆積方式為 。已知:鋁原子半徑為d cm,摩爾質量為M g·mol-1,阿伏加德羅常數的值為NA,則晶體鋁的密度ρ= (表達式)。
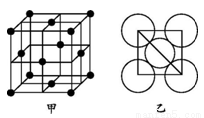
查看答案和解析>>
科目: 來源:2016屆寧夏銀川二中高三5月適應性訓練理綜化學試卷(解析版) 題型:實驗題
有甲、乙、丙三種物質:
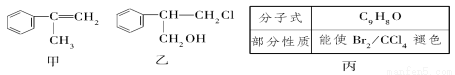
(1)乙中含有的官能團的名稱為________。
(2)由甲轉化為乙需經下列過程(已略去各步反應的無關產物,下同):

其中反應Ⅰ的反應類型是______________,反應Ⅱ的條件是__________________,反應Ⅲ的化學方程式為_________________(不需注明反應條件)。
(3)由甲出發合成丙的路線之一如下
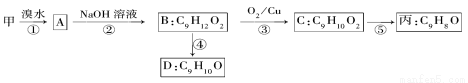
①下列物質不能與B反應的是________(填字母)。
a.金屬鈉 b.FeCl3  c.碳酸鈉溶液 d.HBr
c.碳酸鈉溶液 d.HBr
②丙的結構簡式為______________。
③D符合下列條件的所有同分異構體________種,任寫其中一種能同時滿足下列條件的同分異構體結構簡式:___________。
a.苯環上的一氯代物有兩種 b.遇FeCl3溶液發生顯色反應 c.能與Br2/CCl4溶液反應
查看答案和解析>>
科目: 來源:2016屆山東省高三5月高考拉練一模理綜化學試卷(解析版) 題型:選擇題
明代《天工開物》記載“火法”冶煉鋅: “爐甘石十斤,裝載入一泥罐內,…然后逐層用煤炭餅墊盛,其底鋪薪,發火煅紅,…冷淀,毀罐取出,…,即倭鉛也”(注:爐甘石的主要成分為碳酸鋅,泥罐中摻有煤炭)。下列說法不正確的是
A.倭鉛是指金屬鋅和鉛的混合物
B.煤炭中起作用的主要成分是C
C.冶煉Zn的反應方程式為:ZnCO3+2C Zn+3CO↑
Zn+3CO↑
D.該冶煉鋅的方法屬于熱還原法
查看答案和解析>>
科目: 來源:2016屆山東省高三5月高考拉練一模理綜化學試卷(解析版) 題型:選擇題
下列化學用語表示正確的是
A.中子數為20的氯原子:
B.二氧化硅的分子式:SiO2
C.硫化氫的結構式:H—S—H
D.氯化銨的電子式:
查看答案和解析>>
科目: 來源:2016屆山東省高三5月高考拉練一模理綜化學試卷(解析版) 題型:選擇題
2015年中美專家研制出可在一分鐘內完成充電的超常性能鋁離子電池,分別以金屬鋁和石墨為電極,用AlCl4-、A12C17-和有機陽離子組成電解質溶液,其放電工作原理如右圖所示。下列說法不正確的是
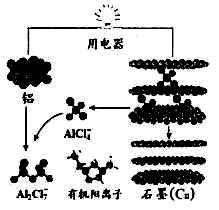
A.放電時,鋁為負極、石墨為正極
B.充電時的陽極反應為:Cn+ AlCl4--e-= Cn AlCl4
C.放電時的負極反應為:Al-3e-+7 AlCl4-=4A12C17-
D.放電時,有機陽離子向鋁電極方向移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com