
科目: 來源: 題型:
| 壓強/MPa 轉化率/% 溫度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目: 來源: 題型:
 )為基本原料,經過反應得到一系列的芳炔類大環化合物,其結構為:
)為基本原料,經過反應得到一系列的芳炔類大環化合物,其結構為:
 )為起始物質,通過加成、消去反應制得.寫出由苯乙烯制取苯乙炔的化學方程式(所需的無機試劑自選)
)為起始物質,通過加成、消去反應制得.寫出由苯乙烯制取苯乙炔的化學方程式(所需的無機試劑自選)查看答案和解析>>
科目: 來源: 題型:
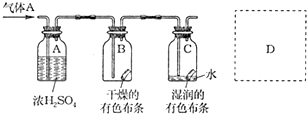
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
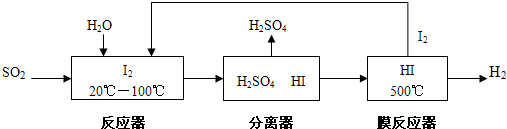
| 反應時間/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目: 來源: 題型:

| ||
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:
 2007年諾貝爾化學獎授予德國科學家格哈德?埃特爾,以表彰他在表面化學研究領域作出的開拓性貢獻.
2007年諾貝爾化學獎授予德國科學家格哈德?埃特爾,以表彰他在表面化學研究領域作出的開拓性貢獻.
| ||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com