
| 反應時間/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 0.4×0.4 |
| 0.8×0.2 |
| ||
| ||


 全能測控一本好卷系列答案
全能測控一本好卷系列答案 發(fā)散思維新課堂系列答案
發(fā)散思維新課堂系列答案科目:高中化學 來源: 題型:
| A、Fe3+、K+、NO3-、SO42- |
| B、Al3+、Na+、HCO3-、SO42- |
| C、NO3-、K+、Al(OH)4-、HSO3- |
| D、Na+、K+、S2O32-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 2007年諾貝爾化學獎授予德國科學家格哈德?埃特爾,以表彰他在表面化學研究領域作出的開拓性貢獻.
2007年諾貝爾化學獎授予德國科學家格哈德?埃特爾,以表彰他在表面化學研究領域作出的開拓性貢獻.
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
 (1)如圖所示裝置,回答下列問題鹽橋中陰離子移向
(1)如圖所示裝置,回答下列問題鹽橋中陰離子移向
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
 科學家一直致力于“人工固氮”的方法研究.合成氨的原理為:N2(g)+3H2(g)?2NH3(g),該反應的能量變化如圖所示.
科學家一直致力于“人工固氮”的方法研究.合成氨的原理為:N2(g)+3H2(g)?2NH3(g),該反應的能量變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:
| 次序 | 鹽酸 | 剩余固體 |
| 1 | 先加入5.00mL | 1.32g |
| 2 | 再加入5.00mL | 0.64g |
| 3 | 再加入5.00mL | 0.20g |
| 4 | 再加入5.00mL | 0.20g |
查看答案和解析>>
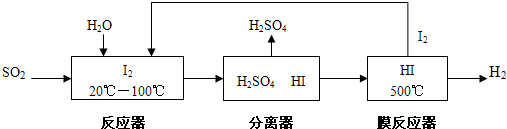
科目:高中化學 來源: 題型:
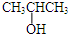 ⑨CH≡CH.
⑨CH≡CH.查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com