
科目: 來源:不詳 題型:單選題
| A.一定條件下,使用催化劑能加快反應速率但不能改變平衡轉化率 |
| B.氫氧燃料電池的能量轉換形式僅為化學能轉化為電能 |
| C.在NH4HSO4溶液中由于NH4+的水解促進了水的電離,所以水的電離程度增大 |
D.在一密閉容器中發生2SO2+O2 2SO3反應,增大壓強,平衡會正向移動, 2SO3反應,增大壓強,平衡會正向移動,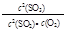 的值增大 的值增大 |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
 2CH3OH(g) △H= 37Kj·mol-1
2CH3OH(g) △H= 37Kj·mol-1 3 H2(g)+CO2(g) △H =49Kj·mol-1
3 H2(g)+CO2(g) △H =49Kj·mol-1 CO(g) +H2O(g) △H=41.3Kj·mol-1
CO(g) +H2O(g) △H=41.3Kj·mol-1 CH3OH(g) △H <0。現將l0mol CO與20mol H2置于密閉容器中,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(
CH3OH(g) △H <0。現將l0mol CO與20mol H2置于密閉容器中,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(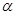 )與溫度、壓強的關系如下圖所示。
)與溫度、壓強的關系如下圖所示。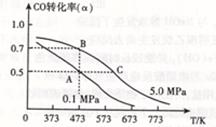
查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.反應NH3(g)+HCl(g)=NH4Cl(s)低溫下能自發進行,說明該反應的△H<0 |
| B.Mg在空氣中燃燒時發出耀眼的白光,可用于制造信號彈 |
| C.純堿溶于熱水中去污效果增強,說明純堿的水解是吸熱反應 |
| D.反應N2(g)+3H2(g)=2NH3(g)(△H<0)達平衡后,降低溫度,正反應速率增大、逆反應速率減小,平衡向正反應方向移動 |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
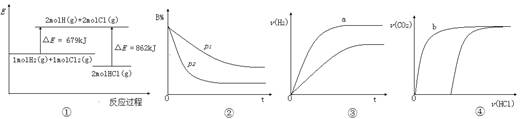
| A.①表示反應H2(g)+Cl2(g)=2HCl(g)的能量變化,則該反應的△H="183" kJ·mol-1 |
B.②表示其它條件不變時,反應4A(g)+3B(g) 2C(g)+6D在不同壓強下B%(B的體積分數)隨時間的變化,則D一定是氣體 2C(g)+6D在不同壓強下B%(B的體積分數)隨時間的變化,則D一定是氣體 |
| C.③表示體積和pH均相同的HCl、CH3COOH兩種溶液中,分別加入足量的鋅,產生H2的體積隨時間的變化,則a表示的是HCl溶液 |
| D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3兩種溶液中,分別滴加0.l mol/L HCl溶液時,CO2的體積隨鹽酸體積的變化,則b表示的是NaHCO3溶液 |
查看答案和解析>>
科目: 來源:不詳 題型:單選題

| A.圖①表示室溫時,用0.1 mol.L-1鹽酸滴定0.1 mol·L-1NaOH溶液過程中的pH變化 |
B.T℃時,反應2NO2(g) N2O4(g)達到平衡時NO2的體積分數 N2O4(g)達到平衡時NO2的體積分數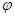 (NO2)隨壓強P的變化如圖②所示,則A點的顏色深,B點的顏色淺 (NO2)隨壓強P的變化如圖②所示,則A點的顏色深,B點的顏色淺 |
C.圖③表示向絕熱恒容密閉容器中通入A2和B2,一定條件下使反應2A2(g)+B2(g) 2C(g),達到平衡,正反應速率隨時間變化的示意圖。由圖可得出的結論是:反應物的總能量低于生成物的總量 2C(g),達到平衡,正反應速率隨時間變化的示意圖。由圖可得出的結論是:反應物的總能量低于生成物的總量 |
D.圖④在恒溫恒容的密閉容器中,氣體M存在如下關系xM(g) Mx(g),t1時刻,保持溫度不變,再充入1 mol M,重新達到平衡時 Mx(g),t1時刻,保持溫度不變,再充入1 mol M,重新達到平衡時 將增大 將增大 |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
| 化學式 | HF | H2CO3 | HClO |
| 電離平衡常數 (K) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
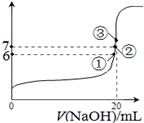
 SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1查看答案和解析>>
科目: 來源:不詳 題型:填空題
 CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。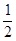 O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol; CH3OH(g),下列表示該反應達到平衡狀態的標志有 (填字母序號)。
CH3OH(g),下列表示該反應達到平衡狀態的標志有 (填字母序號)。| A.有1個H—H鍵生成的同時有 3個C—H鍵生成 |
| B.CO百分含量保持不變 |
| C.容器中混合氣體的壓強不變化 |
| D.容器中混合氣體的密度不變化 |
 H2(g)+ CO2(g) △H<0,某溫度下該反應的平衡常數K=1。若起始時c(CO)=1mol?L-1,c(H2O)=2mol?L-1,試回答下列問題:
H2(g)+ CO2(g) △H<0,某溫度下該反應的平衡常數K=1。若起始時c(CO)=1mol?L-1,c(H2O)=2mol?L-1,試回答下列問題:
查看答案和解析>>
科目: 來源:不詳 題型:填空題

 2SO3(g)。反應體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態)。根據圖示回答下列問題:
2SO3(g)。反應體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態)。根據圖示回答下列問題:
 0(填“>’或“<”)。
0(填“>’或“<”)。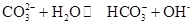 ,25℃時該反應的K=2×10-4mol·L-1,則當溶液中c(HCO- 3):c(CO2- 3)=2∶1時,溶液的pH= 。
,25℃時該反應的K=2×10-4mol·L-1,則當溶液中c(HCO- 3):c(CO2- 3)=2∶1時,溶液的pH= 。查看答案和解析>>
科目: 來源:不詳 題型:填空題
 2NH3(g),則在電解法合成氨的過程中,應將H2不斷地通入_________極(填“陰”或“陽”) ;向另一電極通入N2,該電極的反應式為__________________________。
2NH3(g),則在電解法合成氨的過程中,應將H2不斷地通入_________極(填“陰”或“陽”) ;向另一電極通入N2,該電極的反應式為__________________________。 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。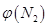 與反應溫度T的關系曲線如圖所示,則上述反應的Q________0(填“>”、“<”或“=”)。
與反應溫度T的關系曲線如圖所示,則上述反應的Q________0(填“>”、“<”或“=”)。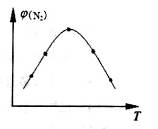
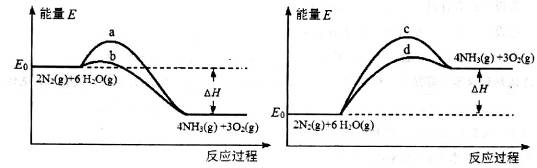
 2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。查看答案和解析>>
科目: 來源:不詳 題型:計算題
 CO2(g)+H2(g),得到如下兩組數據:
CO2(g)+H2(g),得到如下兩組數據:| 實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com