
 2CH3OH(g) △H= 37Kj·mol-1
2CH3OH(g) △H= 37Kj·mol-1 3 H2(g)+CO2(g) △H =49Kj·mol-1
3 H2(g)+CO2(g) △H =49Kj·mol-1 CO(g) +H2O(g) △H=41.3Kj·mol-1
CO(g) +H2O(g) △H=41.3Kj·mol-1 CH3OH(g) △H <0。現將l0mol CO與20mol H2置于密閉容器中,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(
CH3OH(g) △H <0。現將l0mol CO與20mol H2置于密閉容器中,在催化劑作用下發生反應生成甲醇,CO的平衡轉化率(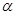 )與溫度、壓強的關系如下圖所示。
)與溫度、壓強的關系如下圖所示。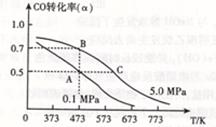
 6H2(g)+2CO2(g) △H= 135kJ·mol-1
6H2(g)+2CO2(g) △H= 135kJ·mol-1 6H2(g)+2CO2(g) △H= 135kJ·mol-1
6H2(g)+2CO2(g) △H= 135kJ·mol-1

科目:高中化學 來源:不詳 題型:單選題
| A.①② | B.①②④ | C.①②③ | D.①②③④ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 4NO2(g)+O2(g);△H>0。反應至5分鐘時各物質的濃度不再發生變化,測得NO2的體積分數為50%。
4NO2(g)+O2(g);△H>0。反應至5分鐘時各物質的濃度不再發生變化,測得NO2的體積分數為50%。 N2O4(g),平衡時N2O4與NO2的物質的量之比為a,其它條件不變的情況下,分別再充入NO2和再充入N2O4,平衡后引起的變化正確的是__________。
N2O4(g),平衡時N2O4與NO2的物質的量之比為a,其它條件不變的情況下,分別再充入NO2和再充入N2O4,平衡后引起的變化正確的是__________。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.催化劑通過降低化學反應的焓變加快化學反應速率 |
| B.鉛蓄電池充電時.標有“一”的電極應與電源的負極相連 |
| C.溫度保持不變.向水中加入鈉鹽對水的電離一定沒有影響 |
| D.向醋酸鈉溶液中加水稀釋時.溶液中所有離子濃度都減小 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。 O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol; CH3OH(g),下列表示該反應達到平衡狀態的標志有 (填字母序號)。
CH3OH(g),下列表示該反應達到平衡狀態的標志有 (填字母序號)。| A.有1個H—H鍵生成的同時有 3個C—H鍵生成 |
| B.CO百分含量保持不變 |
| C.容器中混合氣體的壓強不變化 |
| D.容器中混合氣體的密度不變化 |
 H2(g)+ CO2(g) △H<0,某溫度下該反應的平衡常數K=1。若起始時c(CO)=1mol?L-1,c(H2O)=2mol?L-1,試回答下列問題:
H2(g)+ CO2(g) △H<0,某溫度下該反應的平衡常數K=1。若起始時c(CO)=1mol?L-1,c(H2O)=2mol?L-1,試回答下列問題:
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 H2NCOONH4(氨基甲酸銨)(l) △H1
H2NCOONH4(氨基甲酸銨)(l) △H1 H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2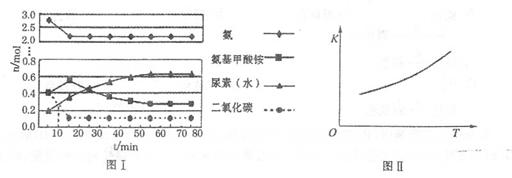
 。實驗測得不同溫度下的平衡數據列于下表:
。實驗測得不同溫度下的平衡數據列于下表:| 溫度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.SO2、Cl2都能使品紅溶液褪色 |
| B.NH4Cl晶體、固體碘受熱都會汽化 |
| C.福爾馬林、葡萄糖與新制Cu(OH)2共熱都有紅色沉淀生成 |
| D.苯、乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

 N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
 N2O4已經達到平衡。
N2O4已經達到平衡。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.pH=7的溶液一定是中性溶液 |
| B.能自發進行的化學反應,不一定是△H<0、△S>0 |
| C.吸熱反應發生過程中要不斷從外界獲得能量,放熱反應一定不需要吸收外界能量 |
| D.Ksp不僅與難溶電解質的性質和溫度有關,而且與溶液中的離子濃度有關 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com