
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Cl-、Fe2+、K+ | D. | NO3-、AlO2-、OH-、K+ |
分析 加入鋁粉能放出氫氣的溶液,為非氧化性酸或強堿溶液,根據離子之間不能結合生成沉淀、氣體、水等,不能發生氧化還原反應等,則離子大量共存,以此來解答.
解答 解:加入鋁粉能放出氫氣的溶液,為非氧化性酸或強堿溶液,
A.酸性溶液中不能大量存在CO32-,堿性溶液中不能大量存在NH4+,故A不選;
C.酸性溶液中不能大量存在HCO3-,堿性溶液中不能大量存在Mg2+、HCO3-,故B不選;
C.酸性溶液中NO3-、Fe2+、H+發生氧化還原反應,堿性溶液中不能大量存在Fe2+,故C不選;
D.堿性溶液中該組離子之間不反應,可大量共存,故D選;
故選D.
點評 本題考查離子的共存,為高頻考點,把握習題中的信息及常見離子之間的反應為解答的關鍵,側重分析與應用能力的考查,注意復分解反應的判斷,題目難度不大.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
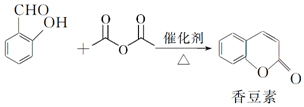
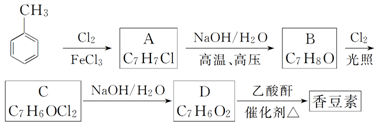
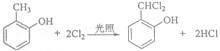 ;
;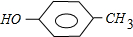 和
和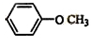 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題


查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
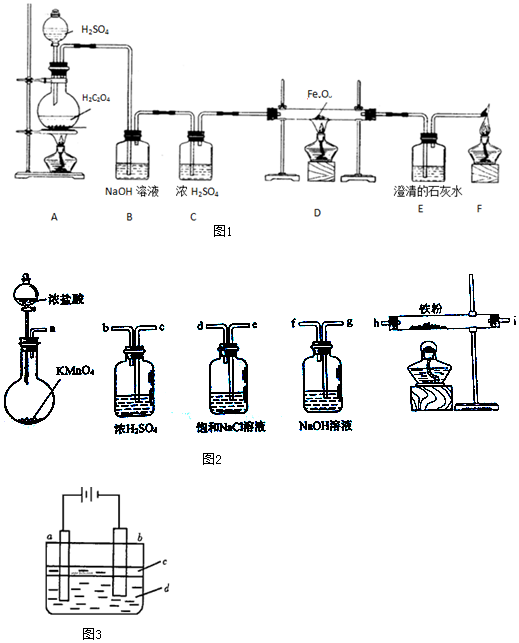
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若忽略水的電離及H2CO3的第二級電離,則H2CO3?HCO3-+H+的平衡常數K1=4.2×10-7 | |
| B. | 少量Cl2通入到過量的Na2CO3溶液的離子方程式為Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO- | |
| C. | Cl2與Na2CO3按物質的量之比1:1恰好反應的離子方程式為Cl2+CO32-+H2O═HCO3-+Cl-+HClO | |
| D. | 少量CO2通入到過量的NaClO溶液的離子方程式為2ClO-+CO2+H2O═CO32-+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 滴定次數 | 待測氫氧化鈉溶液的體積/mL | 0.1000mol/L鹽酸的體積(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩種氣體的物質的量相等 | B. | O2比O3的質量小 | ||
| C. | 兩種氣體的分子數目相等 | D. | 兩種氣體中的氧原子數目相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com