
分析 采用假設法分析,假設a=b,保持溫度不變,將容器體積增加一倍,平衡不移動,A和B的濃度應均是原來的$\frac{1}{2}$倍,與達到新的平衡時A的濃度變相比判斷平衡移動,再根據平衡移動逐項判斷.
解答 解:采用假設法分析,假設a=b,保持溫度不變,將容器體積增加一倍,平衡不移動,A和B的濃度應均是原來的$\frac{1}{2}$倍,但當達到新的平衡時,A的濃度是原來的60%,說明減小壓強平衡向逆反應反應方向移動,所以a>b,
故答案為:>;減小壓強,平衡逆向移動,又因減小壓強平衡向氣體分子數增大的方向移動.
點評 本題考查化學平衡移動問題,題目難度不大,注意通過改變體積濃度的變化判斷平衡移動的方向,此為解答該題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 在101kPa下,1g物質完全燃燒所放出的熱量叫做該物質的熱值 | |
| B. | 把FeCl3的水溶液加熱蒸干可得到FeCl3固體 | |
| C. | 用25mL堿式滴定管量取20.00mL高錳酸鉀溶液 | |
| D. | 太陽能電池是把太陽能轉化為內能的裝置 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 沸點/K | 標準狀況時在水中的溶解度 | |
| H2S | 202 | 2.6 |
| H2O2 | 423 | 以任意比互溶 |
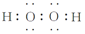
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2SO2(g)+2O2(g)?2SO3(g)是生產硫酸的主要反應之一.下表是原料氣按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa時,不同溫度下SO2的平衡轉化率.
2SO2(g)+2O2(g)?2SO3(g)是生產硫酸的主要反應之一.下表是原料氣按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa時,不同溫度下SO2的平衡轉化率.| 溫度/ | 400 | 500 | 600 |
| SO2轉化率/% | 99.2 | 93.5 | 73.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Cl-、Fe2+、K+ | D. | NO3-、AlO2-、OH-、K+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com