
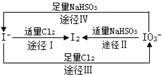
| A. | 由圖可知離子還原性的強弱順序為HSO3->I->Cl- | |
| B. | 足量Cl2能使濕潤的淀粉-KI試紙先變藍后變白 | |
| C. | 途徑Ⅱ、Ⅳ反應后溶液的pH均減小 | |
| D. | 途徑Ⅲ中若氧化1 mol I-,需消耗67.2L氯氣 |
分析 A.氧化還原反應中還原劑的還原性大于還原產物的還原性;
B.根據圖示轉化Ⅲ可知Cl2>NaIO3,氯氣可以將碘氧化HIO3;
C.根據反應的方程式判斷;
D.途徑Ⅲ中若氧化1 mol I-,轉移6mol電子,需要3mol氯氣,但不知氣體是否存在于標準狀況下.
解答 解:A.氧化還原反應中還原劑的還原性大于還原產物的還原性,由途徑Ⅳ可知還原性HSO3->I-,由途徑Ⅰ可知還原性I->Cl-,故A正確;
B.氧化性Cl2>NaIO3,發生5Cl2+I2+6H2O═2HClO3+10HCl,可使已變藍的淀粉-KI試紙褪色,故B正確;
C.途徑Ⅱ、Ⅳ反應的離子方程式分別為2IO3-+5HSO3-═I2+5SO42-+3H++H2O、IO3-+3HSO3-═I-+3SO42-+3H+,反應后溶液的pH均減小,故C正確;
D.途徑Ⅲ中若氧化1 mol I-,轉移6mol電子,需要3mol氯氣,但不知氣體是否存在于標準狀況下,故D錯誤.
故選D.
點評 本題考查氧化還原反應的計算,為高考常見題型和高頻考點,側重于學生的分析能力和計算能力的考查,注意從元素化合價的角度認識氧化還原反應的相關概念和物質的性質,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,pH均等于4的硫酸溶液與醋酸溶液,兩種溶液中c(SO42-)與c(CH3COO-)之比為1:2 | |
| B. | 常溫下,向pH=4.0的醋酸溶液中加入水稀釋后,溶液中c(H+)和c(OH-)都將變小 | |
| C. | 常溫下,0.1mol/L NaHA溶液的PH=5,溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂著火后可用二氧化碳滅火器進行滅火 | |
| B. | 焰色反應時,先用稀硫酸洗滌鉑絲并在酒精燈火焰上灼燒,然后再進行實驗 | |
| C. | 食鹽水中混有Mg2+、Ca2+、SO42-,可依次加入過量Ba(OH)2溶液、Na2CO3溶液和適量鹽酸,過濾后即可得到精制的食鹽水 | |
| D. | 現代化學分析測試中,常借助一些儀器來分析化學物質的組成.如用原子吸收光譜確定物質中含有哪些金屬元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3mol | B. | 2mol | C. | $\frac{4}{3}$mol | D. | $\frac{10}{3}$mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | N2 | B. | NO2 | C. | NH3 | D. | NO |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com