
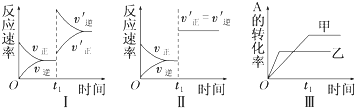
| A. | 圖Ⅰ表示的是t1時刻增大反應物的濃度對反應速率的影響 | |
| B. | 圖Ⅱ表示的一定是t1時刻加入催化劑后對反應速率的影響 | |
| C. | 圖Ⅲ表示的是溫度對化學平衡的影響,且乙的溫度較高 | |
| D. | 圖Ⅲ表示的是不同催化劑對平衡的影響,且甲的催化效率比乙高 |
分析 A、增大反應物的濃度,正逆反應速率均增大,但是在增大的瞬間,逆反應速率不變;
B、催化劑只改變反應速率,不影響平衡的移動,對反應前后氣體體積不變的反應,增大壓強,也只改變反應速率,不影響平衡的移動;
C、升高溫度,化學平衡向著吸熱方向進行;
D、催化劑只改變反應速率,不影響平衡的移動.
解答 解:A、增大反應物的濃度,正逆反應速率均增大,但是在增大的瞬間,逆反應速率不變,所以逆反應速率在t1時刻不變,不會離開原平衡點,故A錯誤;
B、催化劑只改變反應速率,不影響平衡的移動,和本圖結果一樣,該反應前后氣體體積不變的反應,增大壓強,也只改變反應速率,不影響平衡的移動,和本圖結果一樣,故B錯誤;
C、升高溫度,化學平衡向著逆方向進行,反應物A的轉化率減小,A的轉化率在圖中是乙<甲,所以乙的溫度較高,故C正確;
D、催化劑只改變反應速率,不影響平衡的移動,各物質的轉化率不變,故D錯誤.
故選C.
點評 本題是一道有關化學反應速率和化學平衡知識的圖象題,注意固定變量法的運用,難度較大,考查角度廣.


 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案 同步練習西南師范大學出版社系列答案
同步練習西南師范大學出版社系列答案 補充習題江蘇系列答案
補充習題江蘇系列答案 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 元素原子核外電子層排布呈周期性變化 | |
| B. | 元素相對原子質量依次遞增 | |
| C. | 元素原子半徑大小呈周期性變化 | |
| D. | 元素的最高正化合價呈周期性變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉和冷水反應:Na+H2O=Na++OH一+H2↑ | |
| B. | 鐵粉投入到硫酸銅溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH一=Al(OH)3↓ | |
| D. | 氯化亞鐵溶液中通入氯氣:Fe2++Cl2=Fe3++2Cl一 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子晶體 | B. | 離子晶體 | C. | 分子晶體 | D. | 金屬晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 63% | B. | 54% | C. | 12% | D. | 9% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2:3 | B. | 46:56:27 | C. | 6:3:2 | D. | 1/23:1/28:1/9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A~F六種元素中,除C外其他均為短周期元素,它們的原子結構或性質如下表所示.
A~F六種元素中,除C外其他均為短周期元素,它們的原子結構或性質如下表所示.| 元素 | 原子結構或性質 |
| A | 原子最外層電子數是內層電子總數的$\frac{1}{5}$ |
| B | 形成化合物種類最多的元素,其單質為固體 |
| C | 生活中常見的金屬,它有兩種常見的氯化物,且相對分子質量相差35.5 |
| D | 地殼中含量最多的元素 |
| E | 與D同主族 |
| F | 與E同周期,且最外層電子數等于電子層數 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com