

分析 該裝置中A目的是制取CO2氣體,實驗室用稀鹽酸和CaCO3反應制取CO2,鹽酸具有揮發性,所以制取的CO2中含有HCl,為防止干擾實驗;用B裝置吸收HCl但不能影響CO2,B中盛放的物質是飽和NaHCO3溶液;B中溶液含有水分,能和Na反應,為防止干擾實驗,C中用濃硫酸干燥CO2;D中Na和CO2發生反應,E用來吸收CO2,F檢驗CO,
(1)為了使制氣裝置能“隨開隨用,隨關隨停”,其裝置應該和啟普發生器相似;CaCO3和稀鹽酸反應生成氯化鈣、二氧化碳和水;實驗室用飽和碳酸氫鈉吸收HCl;用濃硫酸干燥二氧化碳;
(2)點燃酒精噴燈得到的溫度較高;空氣中氧氣能和Na在點燃條件下生成過氧化鈉;
(3)①根據元素守恒知,能和稀鹽酸反應生成能使澄清石灰水變渾濁的氣體是二氧化碳,則得到的其中一種固體是碳酸鈉,根據元素化合價變化知,生成的另一種固體是C;
②根據元素守恒知,能和稀鹽酸反應生成能使澄清石灰水變渾濁的氣體是二氧化碳,則得到的其中一種固體是碳酸鈉,F中生成黑色固體,D中生成CO;
(4)任何化學反應都遵循質量守恒定律,根據質量守恒定律確定產物成分.
解答 解:該裝置中A目的是制取CO2氣體,實驗室用稀鹽酸和CaCO3反應制取CO2,鹽酸具有揮發性,所以制取的CO2中含有HCl,為防止干擾實驗;用B裝置吸收HCl但不能影響CO2,B中盛放的物質是飽和NaHCO3溶液;B中溶液含有水分,能和Na反應,為防止干擾實驗,C中用濃硫酸干燥CO2;D中Na和CO2發生反應,E用來吸收CO2,F檢驗CO,
(1)為了使制氣裝置能“隨開隨用,隨關隨停”,其裝置應該和啟普發生器相似,只有Ⅲ符合;CaCO3和稀鹽酸反應生成氯化鈣、二氧化碳和水,離子方程式為CaCO3+2H+=Ca2++H2O+CO2↑;實驗室用稀鹽酸和CaCO3反應制取CO2,鹽酸具有揮發性,所以制取的CO2中含有HCl,為防止干擾實驗;用B裝置吸收HCl但不能影響CO2,B中盛放的物質是飽和NaHCO3溶液;B中溶液含有水分,能和Na反應,為防止干擾實驗,C中用濃硫酸干燥CO2;
故答案為:Ⅲ;CaCO3+2H+=Ca2++H2O+CO2↑;飽和NaHCO3;濃H2SO4;
(2)點燃酒精噴燈得到的溫度較高,所以其反應條件為高溫(或強熱);空氣中氧氣能和Na在點燃條件下生成過氧化鈉,干擾實驗,用二氧化碳將空氣排出,防止干擾實驗,所以應該打開Ⅲ中的止水夾,
故答案為:高溫(強熱);打開Ⅲ中的止水夾;排出該裝置中的空氣;
(3)①根據元素守恒知,能和稀鹽酸反應生成能使澄清石灰水變渾濁的氣體是二氧化碳,則得到的其中一種固體是碳酸鈉,根據元素化合價變化知,生成的另一種固體是C,根據反應物、生成物及反應條件得方程式為4Na+3CO2 $\frac{\underline{\;高溫\;}}{\;}$ 2Na2CO3+C,故答案為:4Na+3CO2 $\frac{\underline{\;高溫\;}}{\;}$ 2Na2CO3+C;
②根據元素守恒知,能和稀鹽酸反應生成能使澄清石灰水變渾濁的氣體是二氧化碳,則得到的其中一種固體是碳酸鈉,F中生成黑色固體,D中生成CO,根據反應物、生成物及反應條件得方程式為2Na+2CO2$\frac{\underline{\;高溫\;}}{\;}$ Na2CO3+CO,故答案為:2Na+2CO2$\frac{\underline{\;高溫\;}}{\;}$ Na2CO3+CO;
(4)任何化學反應都遵循質量守恒定律,根據質量守恒定律知,生成物中含有C、O、Na元素,不含H元素,所以生成物只能是正鹽不能是酸式鹽,
故答案為:正鹽;根據質量守恒定律可知,反應物共有三種元素,沒有氫元素,因此不能生成酸式鹽(或生成正鹽因為高溫條件下碳酸氫鈉不存在).
點評 本題考查性質實驗方案設計,為高頻考點,明確實驗原理是解本題關鍵,知道裝置中每個裝置的作用及實驗目的,同時考查學生實驗設計能力及思維的縝密性,難點是(3)題.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
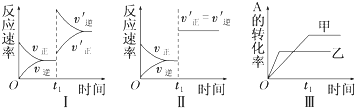
| A. | 圖Ⅰ表示的是t1時刻增大反應物的濃度對反應速率的影響 | |
| B. | 圖Ⅱ表示的一定是t1時刻加入催化劑后對反應速率的影響 | |
| C. | 圖Ⅲ表示的是溫度對化學平衡的影響,且乙的溫度較高 | |
| D. | 圖Ⅲ表示的是不同催化劑對平衡的影響,且甲的催化效率比乙高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 日常生活中無水乙醇常用于殺菌消毒 | |
| B. | 棉、麻、絲、毛及合成纖維完全燃燒都只生成CO2和H2O | |
| C. | 加熱能殺死流感病毒式因為病毒的蛋白質受熱變性 | |
| D. | 人造纖維、合成纖維和光導纖維都是有機高分子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常溫下,0.1 mol•L-1HA溶液與0.1 mol•L-1 NaOH溶液正好完全反應時,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常溫下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常溫下,向0.1 mol•L-1CH3COOH 溶液加水稀釋,當溶液的pH從3.0升到4.0時,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原來的10倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
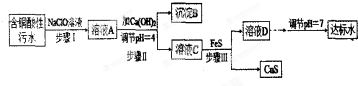
| l離子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 濃度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
| 物質 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14C原子與C60中普通碳原子的化學性質相同 | |
| B. | 14C原子與14N原子所含中子數相同 | |
| C. | 14C是C60的同素異形體 | |
| D. | 14CO與12CO、13CO是碳元素的三種同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體的壓強不變 | B. | 氣體平均相對分子質量不變 | ||
| C. | 氣體的密度不變 | D. | B物質的量濃度不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 燃燒一定要有氧氣參加 | B. | 有發光現象的變化一定是燃燒 | ||
| C. | 燃燒一定有發光發熱現象 | D. | 燃燒的生成物一定有氣體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com