
| A. | 25℃時,水電離出的c(H+)=1×l0-l3 mol/L的溶液中:K+、Ba2+、NO3-、I- | |
| B. | 某無色透明的溶液中:Ca2+、NH4+、HCO3-、CH3COO- | |
| C. | 0.1 mol/L的AlCl3溶液中:Na+、K+、SO42-、S2- | |
| D. | c(H+)=$\sqrt{{K}_{W}}$的溶液中:Na+、Fe3+、CH3COO-、NO3- |
分析 A.25℃時,水電離出的c(H+)=1×l0-l3 mol/L的溶液呈酸性或堿性,離子之間不反應的能大量共存;
B.無色溶液中不含有色離子,離子之間不反應的能大量共存;
C.氯化鋁溶液中不能大量存在和氯化鋁反應的離子;
D.c(H+)=$\sqrt{{K}_{W}}$的溶液呈中性,離子之間不反應的能大量共存.
解答 解:A.25℃時,水電離出的c(H+)=1×l0-l3 mol/L的溶液呈酸性或堿性,酸性條件下NO3-、I-發生氧化還原反應而不能大量共存,故A錯誤;
B.無色溶液中不含有色離子,這幾種離子之間不反應,所以能大量共存,故B正確;
C.Al3+、S2-發生雙水解反應生成氫氧化鋁沉淀和硫化氫氣體而不能大量共存,故C錯誤;
D.c(H+)=$\sqrt{{K}_{W}}$的溶液呈中性,Fe3+在中性條件下產生沉淀而不能大量共存,故D錯誤;
故選B.
點評 本題考查離子共存,為高頻考點,側重考查氧化還原反應、雙水解反應、復分解反應,明確離子性質及離子之間的反應是解本題關鍵,易錯選項是CD,注意鐵離子在酸性溶液中就產生沉淀.


 高中必刷題系列答案
高中必刷題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 5.6g CO和22.4LCO2中含有的碳原子數一定相等 | |
| B. | ngCl2中有m個Cl原子,則阿伏加德羅常數NA的數值可表示為$\frac{35.5m}{n}$ | |
| C. | 標準狀況下,11.2L M氣體分子的質量為16g,則M氣體的摩爾質量是32 | |
| D. | 現有CO、CO2、O3三種氣體,它們均含有1 molO,則三種氣體的物質的量之比為3:2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| X | Y | Z | |
| 第一電離能(KJ/mol) | 526.2 | 502.8 | 425.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 鎂粉和鋁粉分別與等濃度、等體積的過量鹽酸反應,產生氣體的體積(V)與時間(t)關系如圖,下列說法正確的是( )
鎂粉和鋁粉分別與等濃度、等體積的過量鹽酸反應,產生氣體的體積(V)與時間(t)關系如圖,下列說法正確的是( )| A. | 鎂粉和鋁粉的物質的量之比為3:2 | |
| B. | 鎂粉和鋁粉質量之比為3:2 | |
| C. | 鎂粉和鋁粉的摩爾質量之比為2:3 | |
| D. | 鎂粉和鋁粉反應完所需時間之比為3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO>Cl2>Fe3+>Cu2+>Fe2+ | B. | Cl2>HClO>Fe3+>Cu2+>Fe2+ | ||
| C. | Cl2>Fe3+>HClO>Cu2+>Fe2+ | D. | HClO>Cl2>Cu2+>Fe3+>Fe2+. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3種溶液pH的大小順序是 ③>②>① | |
| B. | 若將3種溶液稀釋相同倍數,pH變化最大的是② | |
| C. | 若分別加入25mL0.1mol•L-1鹽酸后,pH最大的是① | |
| D. | 若3種溶液的pH均為9,則物質的量濃度的大小順序是③>①>② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
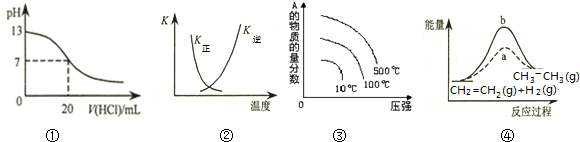
| A. | 圖①表示25℃時,用0.1 mol•L-1鹽酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH隨加入酸體積的變化 | |
| B. | 圖②中曲線表示反應2SO2(g)+O2(g)═2SO3(g)△H<0,正、逆反應的平衡常數K隨溫度的變化 | |
| C. | 對于可逆反應:A2(g)+3B2(g)?2AB3(g)△H>0,圖③表示的是壓強、溫度、A的物質的量的分數的關系 | |
| D. | 圖④中a、b曲線分別表示反應CH2=CH2 (g)+H2(g)→CH3CH3(g)△H<0,使用和未使用催化劑時,反應過程中的能量變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵有良好的導熱性,常用來制作炊具 | |
| B. | 銅的化學性質不活潑,因此可用于制導線 | |
| C. | 廢舊電池中汞的回收可減少對環境的污染 | |
| D. | 鈦合金與人體有很好的“相容性,因此可用來制造人造骨 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com