
分析 (1)達到化學平衡時,正逆反應速率相等,各個組分的濃度不隨著時間的變化而變化,根據(jù)化學平衡的特征,由此衍生出的一系列物理量都不變,據(jù)此來判斷;
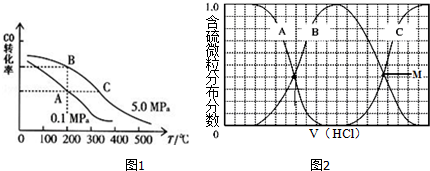
(2)化學反應的平衡常數(shù)隨著溫度的變化而變化;增大壓強或增大H2的濃度,可提高CO平衡轉化率的同時加快反應速率;
(3)①向等物質的量濃度Na2S、NaOH混合溶液中滴加稀鹽酸,鹽酸和氫氧化鈉先反應,然后和硫化鈉反應,結合圖1所示H2S、HS-、S2-的分布分數(shù)進行解答;NaHS的含量先增加后減少;根據(jù)物料守恒可求得滴加過程中,溶液中微粒濃度大小關系;
②根據(jù)電離平衡和水解規(guī)律可得M點時,溶液呈中性.
解答 解:(1)A.每消耗1molCO的同時生成2molH2,能證明正逆反應速率是相等的,故A錯誤;
B、該反應是一個前后氣體系數(shù)和變化的反應,當混合氣體總物質的量不變,達到額化學平衡狀態(tài),故B錯誤;
C.生成CH3OH的速率與消耗CO的速率相等,不能證明正逆反應速率是相等的,此時不一定達到化學平衡,故c正確
D.CH3OH、CO、H2的濃度都不再發(fā)生變化,是化學平衡狀態(tài)的特征,故D錯誤.
故選C;
(2)根據(jù)圖中CO的平衡轉化率(α)與溫度、壓強的關系,當溫度升該時,一氧化碳的轉化率逐漸減小,所以化學平衡向左移動,所以平衡常數(shù)減小,又C點溫度比B高,所以K(B)>K(C),增大壓強或增大H2的濃度,可提高CO平衡轉化率的同時加快反應速率
故答案為:>; 由圖可知,隨著溫度的升高CO的轉化率降低,該反應為放熱反應,放熱反應的平衡常數(shù)隨溫度升高而減小;增大壓強或增大H2的濃度;
(3)①向等物質的量濃度Na2S、NaOH混合溶液中滴加稀鹽酸,鹽酸和氫氧化鈉先反應,然后和硫化鈉反應,A表示含硫微粒濃度減小為S2-,B先增加后減少為HS-,C濃度一直在增加為H2S,向等物質的量濃度Na2S、NaOH混合溶液中滴加稀鹽酸,因體積相同,設Na2S、NaOH各為1mol,則n(Na)=3n(S),溶液中含硫的微粒為HS-、S2-、H2S,則c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或溶液中存在電荷守恒得到c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
故答案為:HS-;c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
②B為HS-,C表示H2S,當?shù)渭欲}酸至M點時,表示兩者含量相等,所以Ka=$\frac{c(HS)•c({H}^{+})}{c({H}_{2}S)}$=c(H+)=1×10-7,故答案為:1×10-7.
點評 本題考查蓋斯離子濃度大小比較、平衡狀態(tài)判斷等,側重于學生的分析能力的考查,為高考常見題型,題目難度較大,注意利用守恒思想比較溶液中微粒濃度大小.


科目:高中化學 來源: 題型:選擇題
| A. | Al2O3→NaAlO2 | B. | Fe→FeCl3 | C. | Na2O→Na2CO3 | D. | SiO2→H2SiO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室通常用如右圖所示的裝置來制取氨氣.回答下列問題:
實驗室通常用如右圖所示的裝置來制取氨氣.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 碳酸鈉溶液和鹽酸反應Na2CO3+2H+═2Na++CO2↑+H2O | |
| B. | 過氧化鈉和水反應2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 鈉跟水反應Na+H2O═Na++OH-+H2↑ | |
| D. | 碳酸氫鈉溶液跟稀硝酸反應HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子半徑:A2->D->B+ | |
| B. | 元素B、C的最高價氧化物對應水化物的堿性:B>C | |
| C. | 簡單氫化物的穩(wěn)定性:A>D | |
| D. | A與B形成的化合物中可能既有離子鍵又有共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溴化亞鐵溶液中通入足量氯氣:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| B. | Cl2與石灰水反應:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 四氧化三鐵與稀硝酸反應:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| D. | 向次氯酸鈣溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,14g CO所含質子數(shù)為7NA | |
| B. | 22g某氣體含分子數(shù)為0.5NA,則其摩爾質量為44 | |
| C. | 標準狀況下,33.6LCH4中含H原子數(shù)為6NA | |
| D. | 1 mol Na 完全反應時,失去NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 難溶于水的BaCO3是弱電解質 | |
| B. | 0.1mol/L的CH3COOH溶液中H+濃度為0.1mol/L | |
| C. | 強電解質水溶液的導電能力一定比弱電解質的強 | |
| D. | 電解質溶液導電的原因是溶液中有自由移動的陰、陽離子 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com