
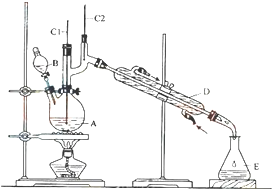
 正丁醛是一種化工原料.某實驗小組利用如圖裝置合成正丁醛.發生的反應如下:
正丁醛是一種化工原料.某實驗小組利用如圖裝置合成正丁醛.發生的反應如下:| 沸點/0C | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
分析 (1)不能將Na2Cr2O7溶液加到濃硫酸中,因為濃硫酸的密度大,容易發生迸濺;
(2)加入沸石的作用是防止暴沸,若加熱后發現未加沸石,應該冷卻后補加;
(3)B儀器的名稱是分液漏斗,D儀器的名稱直形冷凝管;
(4)分液漏斗使用前必須進行的第一項操作是檢漏;
(5)由表中數據可知,正丁醛密度小于水的密度,據此判斷;
(6)根據題目所給反應物和產物的沸點數據可知,反應溫度保持在90~95℃,既可保證正丁醛及時蒸出,又可盡量避免其被進一步氧化;
(7)設正丁醛的理論產量為xg,根據關系式C4H10O~C4H8O列計算出理論產量,根據產率=$\frac{實際產量}{理論產量}$×100%計算.
(8)正丁醛在堿性條件下可以被新制氫氧化銅氧化生成丁酸鈉,氧化亞銅沉淀和水.
解答 解:(1)因為濃硫酸的密度大,能將Na2Cr2O7溶液加到濃硫酸中,容易發生迸濺傷人,
故答案為:不能,濃硫酸溶于水放出大量熱,容易發生迸濺傷人;
(2)加入沸石的作用是防止暴沸,
故答案為:防止暴沸;
(3)B儀器的名稱是分液漏斗,D儀器的名稱直形冷凝管,
故答案為:分液漏斗,直形冷凝管;
(4)分液漏斗使用前必須進行的第一項操作是檢漏,
故答案為:c:
(5)正丁醛密度為0.8017 g•cm-3,小于水的密度,故分層水層在下方,
故答案為:下;
(6)根據題目所給反應物和產物的沸點數據可知,反應溫度保持在90~95℃,既可保證正丁醛及時蒸出,又可盡量避免其被進一步氧化,
故答案為:保證正丁醛及時蒸出,促使反應正向進行,又可盡量避免其被進一步氧化;
(7)設正丁醛的產率為x,則正丁醇的利用率為x,根據關系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=$\frac{74×2}{72×4}$×100%=51%,
故答案為:51;
(8)正丁醛在堿性條件下可以被新制氫氧化銅氧化生成丁酸鈉,氧化亞銅沉淀和水,反應的化學方程式為:CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O,
故答案為:CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O.
點評 本題考查有機化學實驗、反應原理、基本操作、化學計算等,難度不大,注意計算中正丁醇的轉化率等于正丁醛的產率,注意對基礎知識的理解掌握.


科目:高中化學 來源: 題型:選擇題
| A. | 原電池的正極和電解池的陰極所發生的反應分別是氧化反應、還原反應 | |
| B. | 溫度不變,用惰性電極電解飽和碳酸鈉溶液,通電一段時間,溶液的濃度不變,有晶體析出 | |
| C. | 用惰性電極電解CuCl2溶液,一段時間后,要恢復原來的濃度,應加入固體CuSO4 | |
| D. | 以惰性電極電解CuSO4溶液,若陽極上產生的氣體的物質的量為0.010mol,則陰極上析出Cu的質量為12.8g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
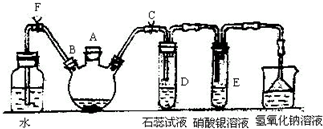 實驗室制備溴苯可用如圖所示的裝置,填寫下列空白:
實驗室制備溴苯可用如圖所示的裝置,填寫下列空白: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com