
| X | Y | W | |
| 起始狀態(mol) | 2 | 1 | 0 |
| 平衡狀態(mol) | 1 | 0.5 | 1.5 |
| A. | 該溫度下,該反應的平衡常數K=9 | |
| B. | 升高溫度,若W的體積分數減小,此反應△H>0 | |
| C. | 該溫度下,該反應的方程式為 2X(g)+Y(g)?3W(g) | |
| D. | 增大壓強,正、逆反應速率都增大,平衡向正反應方向移動 |
分析 由表中數據可知,△n(X)=1mol、△n(Y)=0.5mol、△n(W)=1.5mol,物質的量變化量之比等于化學計量數之比,所以,△n(X):△n(Y):△n(W)=1mol:0.5mol:0.5mol=2:1:3,反應方程式為2X+Y?3W,計算平衡時各物質的濃度,結合K=$\frac{{c}^{3}(W)}{{c}^{2}(X)c(Y)}$計算常數,以此解答該題.
解答 解:由表中數據可知,△n(X)=1mol、△n(Y)=0.5mol、△n(W)=1.5mol,物質的量變化量之比等于化學計量數之比,所以,△n(X):△n(Y):△n(W)=1mol:0.5mol:0.5mol=2:1:3,反應方程式為2X+Y?3W,
A.反應方程式為2X+Y?3W,反應前后氣體的物質的量相同,可以利用物質的量代替濃度計算平衡常數,所以平衡常數k=$\frac{{c}^{3}(W)}{{c}^{2}(X)c(Y)}$=$\frac{1.{5}^{3}}{{1}^{2}×0.5}$=6.75,故A錯誤;
B.升高溫度,若W的體積分數減小,說明平衡逆向移動,則正反應放熱,此反應△H<0,故B錯誤;
C.由以上分析可知該溫度下,該反應的方程式為 2X(g)+Y(g)?3W(g),故C正確;
D.方程式為 2X(g)+Y(g)?3W(g),反應前后體積不變,增大壓強,平衡不移動,故D錯誤.
故選C.
點評 本題考查平衡常數計算、外界條件對平衡移動的影響等,為高考常見題型和高頻考點,難度中等,判斷反應方程式是解題關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 生物質能來深于植物及其加工產品所貯存的能量,直接燃燒是利用方式之一 | |
| B. | 石油的裂化與裂解都是化學變化,而煤的氣化與液化是物理變化 | |
| C. | 用高壓氫氣、氧氣制作燃料電池是氫能源利用的一種重要方式 | |
| D. | 化學反應過程中反應物的總能量小于生成物的總能量,往往伴隨熱量的吸收 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑由小到大的順序為r(X)<r(Y)<r(Z)<r(W) | |
| B. | X、Y、Z既能形成離子化合物,又能形成共價化合物 | |
| C. | Z分別能與X、Y和W形成多種化合物 | |
| D. | 與單質W比較,單質Z更容易與單質X化合 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10.7 mol/L | B. | 8.5 mol/L | C. | 9.6 mol/L | D. | 10.2 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 加入適量水 | B. | 加入適量NaOH固體 | ||
| C. | 通入適量的O2 | D. | 加入適量的CuSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(C)=0.2mol•L-1•s-1 | B. | z=3 | ||
| C. | B的轉化率為25% | D. | C平衡時的濃度為0.5mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 苯乙酸銅是合成優良催化劑、傳感材料--納米氧化銅的重要前驅體之一.下面是它的一種實驗室合成路線:
苯乙酸銅是合成優良催化劑、傳感材料--納米氧化銅的重要前驅體之一.下面是它的一種實驗室合成路線: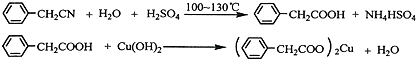
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com