
| A. | 10.7 mol/L | B. | 8.5 mol/L | C. | 9.6 mol/L | D. | 10.2 mol/L |
分析 要計算①的平衡常數=$\frac{c({N}_{2}{O}_{3})({O}_{2})}{c({N}_{2}{O}_{5})}$,可分別計算N2O5、N2O3、O2濃度,關鍵求N2O5的濃度,設分解的N2O3物質的量為x,反應過程中共生成N2O3(x+3.4)mol,則N2O5分解了(x+3.4)mol,再利用氧氣總量9mol,計算x的值,可計算平衡常數.
解答 解:設分解的N2O3物質的量為x,反應過程中共生成N2O3(x+3.4)mol,在①反應中N2O5分解了(x+3.4)mol,同時生成O2(x+3.4)mol.在②反應中生成氧氣xmol.
則(x+3.4)+x=9,
求得x=2.8,
平衡時N2O5、N2O3、O2濃度依次為c(N2O5)=(8-2.8-3.4)÷2=0.9(molL-1 )、c(N2O3)=3.4÷2=1.7(molL-1)、c(O2)=9÷2=4.5(molL-1),
反應①的平衡常數K=$\frac{1.7×4.5}{0.9}$=8.5,
故選B.
點評 本題考查化學平衡常數的計算,為高頻考點,側重于學生的分析、計算能力的考查,本題注意氧氣的體積與分解反應方程式的關系,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | ②③⑦⑤⑥ | B. | ②⑤⑦⑥ | C. | ①③⑤⑦④⑥ | D. | ④③⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化鈉的電子式: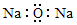 | |
| B. | 質子數為35、中子數為45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫離子的結構示意圖: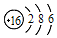 | |
| D. | CCl4的球棍模型: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溫度下的平衡常數是:K=$\frac{9}{16}$ | |
| B. | 達到平衡時,NO的轉化率是60% | |
| C. | 3min末達到平衡,則v(NO)=0.01mol/(L•min) | |
| D. | 升高溫度有利于活性炭處理更多的污染物NO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | x=1 | |
| B. | 平衡時A的濃度為1.5 mol/L | |
| C. | B的轉化率為20% | |
| D. | 反應起始和達到平衡時,混合氣體的壓強比為4:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | Y | W | |
| 起始狀態(mol) | 2 | 1 | 0 |
| 平衡狀態(mol) | 1 | 0.5 | 1.5 |
| A. | 該溫度下,該反應的平衡常數K=9 | |
| B. | 升高溫度,若W的體積分數減小,此反應△H>0 | |
| C. | 該溫度下,該反應的方程式為 2X(g)+Y(g)?3W(g) | |
| D. | 增大壓強,正、逆反應速率都增大,平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
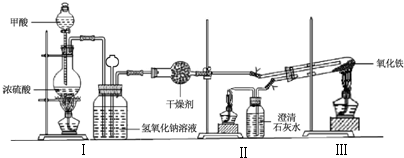
| 加熱方式 | 產物元素組成 | 各元素的質量分數% | |
| Fe | O | ||
| 酒精燈 | Fe和O | 74.50 | 25.50 |
| 帶網罩酒精燈 | Fe和O | 76.48 | 23.52 |
| 酒精噴燈 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 過氧化鈉和水反應:2O22-+2H2O=4OH-+O2↑ | |
| B. | 含等物質的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向氯化鋁溶液中加入過量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 硫化鈉水溶液呈堿性:S2-+H2O?HS-+OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com