
氫是一種理想的綠色清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點。利用FeO/Fe3O4循環制氫,已知:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐標圖分別表示FeO的轉化率(圖-1 )和一定溫度時,H2出生成速率[細顆粒(直徑0.25 mm),粗顆粒(直徑3 mm)](圖-2)。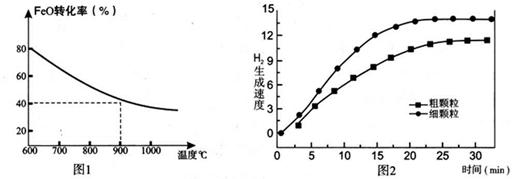
(1)反應:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代數式表示);
(2)上述反應b>0,要使該制氫方案有實際意義,從能源利用及成本的角度考慮,實現反應II可采用的方案是: ;
(3)900°C時,在兩個體積均為2.0L密閉容器中分別投人0.60molFeO和0.20mol H2O(g)甲容器用細顆粒FeO、乙容器用粗顆粒FeO。
①用細顆粒FeO和粗顆粒FeO時,H2生成速率不同的原因是: ;
②細顆粒FeO時H2O(g)的轉化率比用粗顆粒FeO時H2O(g)的轉化率 (填“大”或“小”或“相等”);
③求此溫度下該反應的平衡常數K(寫出計箅過程,保留兩位有效數字)。
(4)在下列坐標圖3中畫出在1000°C、用細顆粒FeO時,H2O(g)轉化率隨時間變化示意圖(進行相應的標注)。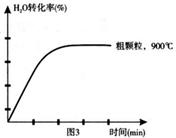
(16分)(1)(2a+b)kJ/mol(2分)(無kJ/mol或“2a+b kJ/mol”扣1分,其他不給分)
(2)用廉價的清潔能源供給熱能(2分)(答用“太陽能”、“風能”、“地熱能”、“生物能”、“核能”供給熱能給3分;答“加熱”、“升高溫度”等均不給分)
(3)①細顆粒FeO表面積大,與H2的接觸面積大,反應速率加快(3分) (“增大接觸面積,加快反應速率”、“接觸面積越大,反應速率越快”等合理表述給3分;答“增大反應物濃度”、“FeO的量增加,反應速率加快”給1分); ②相等(2分)(答“等于”、“=”給1分)
③(4分)解:900℃時,達到平衡時FeO轉化的量為:n(FeO)=0.60mol×40%=0.24mol
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
起始物質的量(mol) 0.20 0.60 0 0
變化物質的量(mol) 0.080 0.24 0.080 0.080
平衡物質的量(mol) 0.12 0.36 0.080 0.080 (2分)
由于固體物質的濃度是常數,不能寫入平衡常數表達式,氣體物質的濃度可以變化,根據c=n/V可求平衡時氫氣和水蒸氣的物質的量濃度,則K=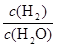 =
=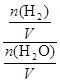 =
=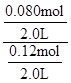 =0.67(2分)
=0.67(2分)
(4)(3分)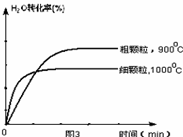
解析試題分析:(1)先對已知熱化學方程式編號為①②,觀察發現①×2+②可得,2H2O(g)=2H2(g)+O2(g),其焓變=①的焓變×2+②的焓變=(2a+b)kJ/mol;(2)b>0,說明反應II是吸熱反應,可用用廉價的清潔能源供給熱能或用“太陽能”、“風能”、“地熱能”、“生物能”、“核能”供給熱能;(3)①FeO是反應I中的固體反應物,細顆粒FeO表面積大,與H2的接觸面積大,反應速率加快(或“增大接觸面積,加快反應速率”、“接觸面積越大,反應速率越快”等);②由于固體物質濃度是常數,FeO的用量和濃度保持不變,將粗顆粒FeO改為細顆粒FeO,只能加快反應速率,不能使平衡移動,因此H2O(g)的平衡轉化率不變或相等;③解:900℃時,達到平衡時FeO轉化的物質的量量為:n(FeO)=0.60mol×40%=0.24mol,則:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
起始物質的量(mol) 0.20 0.60 0 0
變化物質的量(mol) 0.080 0.24 0.080 0.080
平衡物質的量(mol) 0.12 0.36 0.080 0.080
由于固體物質的濃度是常數,不能寫入平衡常數表達式,氣體物質的濃度可以變化,根據c=n/V可求平衡時氫氣和水蒸氣的物質的量濃度,則K=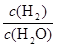 =
=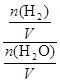 =
=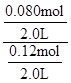 =0.67;
=0.67;
(4)觀察圖1可得:隨著溫度的升高,FeO的平衡轉化率減小,前者導致平衡向吸熱方向移動,后者說明平衡向逆反應方向移動,因此逆反應是吸熱反應,則反應I的正反應是放熱反應;其他條件保持不變時,900℃→1000℃就是升高溫度,既能加快反應速率,又能使平衡向逆反應方向移動,則H2O(g)的轉化率由0逐漸增大,知道達到平衡,1000℃時達到平衡的時間比900℃時少,1000℃時H2O(g)的平衡轉化率比900℃時小,由此可以畫出水蒸氣的轉化率隨溫度變化的示意圖。
考點:考查化學反應原理,涉及蓋斯定律、常見的能量轉化形式、固體反應物顆粒粗細對反應速率和平衡移動的影響、化學平衡常數的計算、溫度對反應速率和平衡移動的影響圖像等。


 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:高中化學 來源: 題型:填空題
氮是地球上含量豐富的原子元素,氮及其化合物在工農業生產、生活中有著重要作用。
(1)25℃時,0.1mol/LNH4NO3溶液中水的電離程度 (填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的電離程度。
(2)若將0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等體積混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中離子濃度由大到小的順序是 。
(3)發射火箭時肼(N2H4)為燃料,二氧化氮作氧化劑,兩者反應生成氮氣和氣態水。經測定16g氣體在上述反應中放出284kJ的熱量。則該反應的熱化學方程式是 。
(4)下圖是1mol NO2和1mol CO反應生成CO2和NO過程中能量變化示意圖。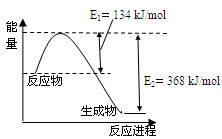
已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
則反應:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
工業上用CO生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g) 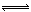 CH3OH(g)。
CH3OH(g)。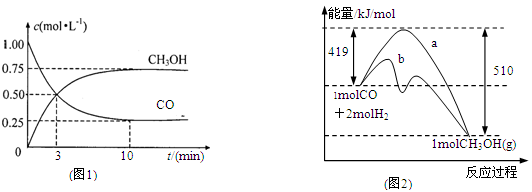
(1)圖1是表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化情況。從反應開始到平衡,用CO濃度變化表示平均反應速率v(CO)=
(2)圖2表示該反應進行過程中能量的變化。曲線a表示不使用催化劑時反應的能量變化,曲線b表示使用催化劑后的能量變化。該反應是_________(選填“吸熱”或“放熱”)反應,寫出反應的熱化學方程式 。
(3)該反應平衡常數K為______________,溫度升高,平衡常數K_________(填“增大”、“不變”或“減小”)
(4)恒容條件下,下列措施中能使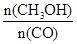 增大的有
增大的有
a.升高溫度 b.充入He氣
c.再充入2 molH2 d.使用催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
I.甲醇是一種優質燃料,可制作燃料電池。工業上可用下列兩種反應制備甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
則2CO(g)+O2(g)=2CO2(g) 的反應熱ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工業上可利用“甲烷蒸氣轉化法生產氫氣”,反應為:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知溫度、壓強和水碳比[n(H2O)/ n(CH4)]對甲烷平衡含量的影響如下圖: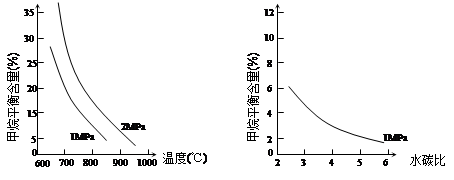
圖1(水碳比為3) 圖2(800℃)
(1)溫度對該反應的反應速率和平衡移動的影響是 。
(2)其他條件不變,請在圖2中畫出壓強為2 MPa時,CH4平衡含量與水碳比之間關系曲線。(只要求畫出大致的變化曲線)
(3)已知:在700℃,1MPa時,1mol CH4與1mol H2O在1L的密閉容器中反應,6分鐘達到平衡,此時CH4的轉化率為80%,求這6分鐘H2的平均反應速率和該溫度下反應的平衡常數是多少?(寫出計算過程,結果保留小數點后一位數字。)
III.某實驗小組設計如圖a所示的電池裝置,正極的電極反應式為____ ____。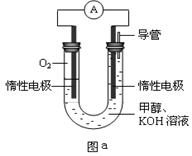
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
工業合成氨的反應為:N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
某實驗將3.0 mol N2(g)和4. 0 mol H2(g)充入容積為10L的密閉容器中,在溫度T1下反應。測得H2的物質的量隨反應時間的變化如下圖所示。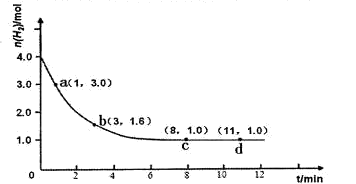
(1)反應開始3min內,H2的平均反應速率為 。
(2)計算該條件下合成氨反應的化學平衡常數(寫出計算過程,結果保留2位有效數字)。
(3)僅改變溫度為T2 ( T2小于TI)再進行實驗,請在答題卡框圖中畫出H2的物質的量隨反應時間變化的預期結果示意圖。
(4)在以煤為主要原料的合成氨工業中,原料氣氫氣常用下述方法獲得:
①C+H2O(g)  CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g)  CO2+H2;
CO2+H2;
已知:CO(g)+1/2O2(g)=CO2(g) △H=—283.0kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=—241.8kJ/mol
寫出上述CO與H2O(g)反應的熱化學方程式: 。
(5)合成氨工業中,原料氣(N2、H2混有少量CO、NH3)在進入合成塔之前,用醋酸二氨合銅(I)溶液來吸收CO,其反應為:
CH3COO[Cu(NH3)2]+CO+NH3 CH3COO[Cu(NH3)3]?CO △H<0
CH3COO[Cu(NH3)3]?CO △H<0
寫出提高CO吸收率的其中一項措施: 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
50 mL 0.50 mol·L-1鹽酸與50 mL 0.55 mol·L-1 NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題: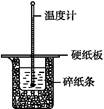
(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品是 。
(2)燒杯間填滿碎紙條的作用是 。
(3)大燒杯上如不蓋硬紙板,求得的中和熱數值 (填“偏大”“偏小”或“無影響”)。
(4)實驗中改用60 mL 0.50 mol·L-1鹽酸跟50 mL 0.55 mol·L-1 NaOH溶液進行反應,與上述實驗相比,所放出的熱量 (填“相等”或“不相等”)。所求中和熱 (填“相等”或“不相等”),簡述理由: 。
(5)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會 ,用50 mL 0.50 mol·L-1 NaOH溶液進行上述實驗,測得的中和熱的數值會 (均填“偏大”“偏小”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
已知:將KI、鹽酸、試劑X和淀粉四種溶液混合,無反應發生。
①向其中滴加雙氧水,發生反應:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即與試劑X反應,當試劑X消耗完后,生成的 I2才會遇淀粉變藍因此,根據試劑X的量、滴入雙氧水至溶液變藍所需的時間,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反應速率。
下表為某同學依據上述原理設計的實驗及實驗記錄(各實驗均在室溫條件下進行):
| 編號 | 往燒杯中加入的試劑及其用量(mL) | 催化劑 | 開始變藍時間(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1mol·Lˉ1 雙氧水 | 1 mol·L1 稀鹽酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 無 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 無 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 無 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |

 2AlI3(s)。含Iˉ傳導有機晶體合成物作為電解質,該電池負極的電極反應為:________________________,充電時Al連接電源的___________極。
2AlI3(s)。含Iˉ傳導有機晶體合成物作為電解質,該電池負極的電極反應為:________________________,充電時Al連接電源的___________極。查看答案和解析>>
科目:高中化學 來源: 題型:單選題
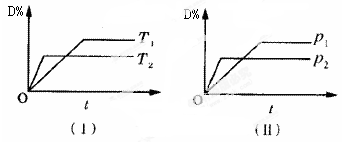
對于可逆反應mA(g)+nB(s) pC(g)+qD(g)反應過程中,其他條件不變時,產物D的質量分數D%與溫度T或壓強p的關系如圖所示,請判斷下列說法正確的是
pC(g)+qD(g)反應過程中,其他條件不變時,產物D的質量分數D%與溫度T或壓強p的關系如圖所示,請判斷下列說法正確的是
| A.降溫,化學平衡向正反應方向移動 |
| B.使用催化劑可使D%有所增加 |
| C.化學方程式中氣體的化學計量數m>p+q |
| D.B的顆粒越小,正反應速率越快,有利于平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在一定溫度下的恒容密閉容器中,當下列哪些物理量不再發生變化時,表明下述反應A(s)+2B(g)  C(g)+D(g)已達到平衡狀態①各氣體物質的物質的量濃度②氣體的總物質的量③混合氣體的壓強④混合氣體的密度
C(g)+D(g)已達到平衡狀態①各氣體物質的物質的量濃度②氣體的總物質的量③混合氣體的壓強④混合氣體的密度
| A.只有①② | B.只有①④ | C.只有①③④ | D.①②③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com