
50 mL 0.50 mol·L-1鹽酸與50 mL 0.55 mol·L-1 NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題: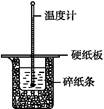
(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品是 。
(2)燒杯間填滿碎紙條的作用是 。
(3)大燒杯上如不蓋硬紙板,求得的中和熱數值 (填“偏大”“偏小”或“無影響”)。
(4)實驗中改用60 mL 0.50 mol·L-1鹽酸跟50 mL 0.55 mol·L-1 NaOH溶液進行反應,與上述實驗相比,所放出的熱量 (填“相等”或“不相等”)。所求中和熱 (填“相等”或“不相等”),簡述理由: 。
(5)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會 ,用50 mL 0.50 mol·L-1 NaOH溶液進行上述實驗,測得的中和熱的數值會 (均填“偏大”“偏小”或“無影響”)。
 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源: 題型:填空題
已知:H+(aq)+OH-(aq)= H2O(l) ΔH="-57.3" kJ/ mol,計算下列中和反應中放出的熱量:
(1)用20 g NaOH配成的稀溶液跟足量的稀鹽酸反應,能放出 kJ的熱量。
(2)用0.1 mol Ba(OH)2配成的稀溶液跟足量的稀硝酸反應,能放出 kJ的熱量。
(3)用1 mol醋酸稀溶液和足量NaOH稀溶液反應,放出的熱量 (填“大于”、“小于”或“等于”)57.3 kJ,理由是 。
(4)1 L 0.1 mol/L NaOH溶液分別與①醋酸溶液、②濃硫酸、③稀硝酸恰好反應時,放出的熱量分別為Q1、Q2、Q3(單位:kJ)。則它們由大至小的順序為 。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
I.工業上可用CO生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)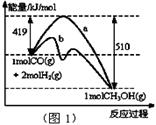
(1)“圖1”表示反應中能量的變化,曲線 (填“a或b”)表示使用了催化劑;該反應的熱化學方程式為 。
(2)若容器容積不變,下列措施可增大CO平衡轉化率的是_____。
| A.升高溫度 |
| B.將CH3OH(g)從體系中分離 |
| C.充入He,使體系總壓強增大 |
| D.再充入1 mol CO和2 mol H2 |
 BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。查看答案和解析>>
科目:高中化學 來源: 題型:計算題
氨是最重要的化工產品之一。
(1)合成氨用的氫氣可以甲烷為原料制得。有關化學反應的能量變化如下圖所示。
反應①②③為_________反應(填“吸熱”或“放熱”)。CH4(g)與H2O(g)反應生成CO(g)和H2(g)的熱化學方程式為__________________。
① ② ③
(2)用氨氣制取尿素[CO(NH2)2]的反應為:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某溫度下,向容積為10L的密閉容器中通入2mol NH3和1molCO2,反應達到平衡時CO2的轉化率為50%。該反應的化學平衡常數表達式為K=___________。該溫度下平衡常數K的計算結果為____________。
②為進一步提高CO2的平衡轉化率,下列措施中能達到目的的是_____________
| A.提高NH3的濃度 | B.增大壓強 |
| C.及時轉移生成的尿素 | D.使用更高效的催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
氫是一種理想的綠色清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點。利用FeO/Fe3O4循環制氫,已知:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐標圖分別表示FeO的轉化率(圖-1 )和一定溫度時,H2出生成速率[細顆粒(直徑0.25 mm),粗顆粒(直徑3 mm)](圖-2)。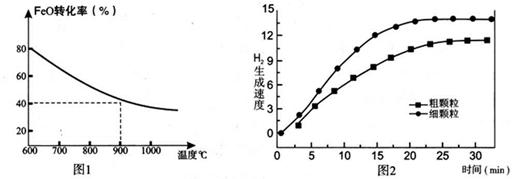
(1)反應:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代數式表示);
(2)上述反應b>0,要使該制氫方案有實際意義,從能源利用及成本的角度考慮,實現反應II可采用的方案是: ;
(3)900°C時,在兩個體積均為2.0L密閉容器中分別投人0.60molFeO和0.20mol H2O(g)甲容器用細顆粒FeO、乙容器用粗顆粒FeO。
①用細顆粒FeO和粗顆粒FeO時,H2生成速率不同的原因是: ;
②細顆粒FeO時H2O(g)的轉化率比用粗顆粒FeO時H2O(g)的轉化率 (填“大”或“小”或“相等”);
③求此溫度下該反應的平衡常數K(寫出計箅過程,保留兩位有效數字)。
(4)在下列坐標圖3中畫出在1000°C、用細顆粒FeO時,H2O(g)轉化率隨時間變化示意圖(進行相應的標注)。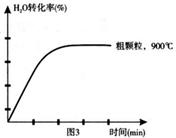
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
用50 mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的氫氧化鈉溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題: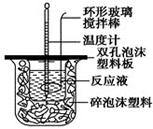
(1)燒杯間填滿碎泡沫塑料的作用是___________________________
(2)環形玻璃攪拌棒能否用環形鐵質攪拌棒代替?_____(填“能”或“不能”),
其原因是_______________________________________________________。
(3)實驗時氫氧化鈉溶液的濃度要用0.55 mol/L的原因是______________________。
實驗中若改用60 mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的氫氧化鈉溶液進行反應, 與上述實驗相比,所放出的熱量_______ _____(填“相等”“不相等”),若實驗操作均正確,則所求中和熱________________(填“相等”“不相等”)。
(4)已知在稀溶液中,強酸和強堿發生中和反應生成1 mol H2O時,放出57.3 kJ的熱量,則上述反應的熱化學方程式為:__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
高爐煉鐵是冶煉鐵的主要方法,發生的主要反應為:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
則a = kJ mol-1。
(2)冶煉鐵反應的平衡常數表達式K = ,溫度升高后,K值 (填“增大”、“不變”或“減小”)。
(3)在T℃時,該反應的平衡常數K=64,在2L恒容密閉容器甲和乙中,分別按下表所示加入物質,反應經過一段時間后達到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
影響化學反應速率與平衡的因素有多方面,如濃度壓強溫度催化劑等。下列有關說法不正確的是
| A.其它條件不變時,改變壓強能改變氣體反應的速率,但不一定改變平衡 |
| B.增大濃度能加快化學反應速率,原因是增大濃度就增加了反應體系中活化分子的百分數 |
| C.溫度升高使化學反應速率加快的主要原因是增加了反應體系中活化分子的百分數 |
| D.加入催化劑能降低反應所需的活化能,使反應速率加快,平衡常數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在鋁與稀硫酸的反應中,已知10 s末硫酸的濃度減少了0.6 mol·L-1,若不考慮反應過程中溶液體積的變化,則10 s內生成硫酸鋁的平均反應速率是( )
| A.0.02 mol·L-1·s-1 | B.1.8 mol·L-1·s-1 | C.1.2 mol·L-1·s-1 | D.0.18 mol·L-1·s-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com