
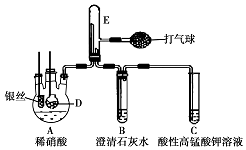
 某化學實驗小組利用如圖裝置證明銀和稀硝酸反應產生NO,D是內置塊狀大理石的多孔玻璃籠.(加熱裝置和夾持裝置均已略去.
某化學實驗小組利用如圖裝置證明銀和稀硝酸反應產生NO,D是內置塊狀大理石的多孔玻璃籠.(加熱裝置和夾持裝置均已略去.分析 證明銀和稀硝酸反應產生NO,實驗時,可先將D裝置中CaCO3放入硝酸中,碳酸鈣和硝酸反應生成二氧化碳氣體,先排出去其中的空氣,以便在E燒瓶中收集到NO,以便觀察顏色,且在B中可觀察到渾濁,有碳酸鈣沉淀生成,A中硝酸和銀反應生成NO,易于氧氣反應,則將氣球中空氣壓入E中,有紅棕色氣體生成,說明銀和稀硝酸反應產生NO,裝置C中盛有酸性高錳酸鉀,可用與吸收尾氣NO,以防止污染空氣,以此解答該題.
解答 解:(1)在連接好裝置后,將C中導管一端伸入水中,微熱三頸燒瓶,若導管口有氣泡冒出,停止加熱后導管內形成一段水柱,則氣密性良好;
故答案為:在連接好裝置后,將C中導管一端伸入水中,微熱三頸燒瓶,若導管口有氣泡冒出,停止加熱后導管內形成一段水柱,則氣密性良好;
(2)①銀與稀HNO3反應生成硝酸銀、NO和水,離子方程式為:3Ag+4H++NO3-═3Ag++NO↑+2H2O;故答案為:3Ag+4H++NO3-═3Ag++NO↑+2H2O;
②E中空氣已被趕盡時,B中石灰水與二氧化碳反應生成碳酸鈣沉淀,可觀察到石灰水變渾濁,出現白色沉淀,故答案為:裝置B中出現白色沉淀;
③銀與稀HNO3反應生成硝酸銀、NO,反應的離子方程式為:3Ag+4H++NO3-═3Ag++NO↑+2H2O,A中硝酸和銀反應生成NO,易與氧氣反應,則將氣球中空氣壓入E中,有紅棕色氣體生成,如觀察到紅棕色,則說明生成NO,
故答案為:將氣球中空氣壓入E中,觀察E中氣體顏色變化;
(3)NO為有毒氣體,C溶液的作用是吸收尾氣NO,酸性高錳酸鉀和一氧化氮發生氧化還原反應,離子方程式為:3MnO4-+4H++5NO═5NO3-+2H2O+3Mn2+,
故答案為:3MnO4-+4H++5NO═5NO3-+2H2O+3Mn2+;
(4)二氧化碳的密度比空氣重,應用向上排空氣法收集,故E中應左導管短,右導管長,才有利于排凈空氣,保證E中全是二氧化碳氣體,保證開始時CO2把空氣全部趕出,
故答案為:把E中進氣管和出氣管改為短進長出,保證開始時CO2把空氣全部趕出.
點評 本題考查了物質性質的實驗驗證設計分析判斷,性質試驗的設計方法,掌握氮及其化合物的性質以及對裝置流程的分析應用是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 配位化合物中必定存在配位鍵 | |
| B. | 配位化合物中只有配位鍵 | |
| C. | 〔Fe(SCN)6〕3-中的Fe3+提供空軌道,SCN-中的硫原子提供孤電子對形成配位鍵 | |
| D. | 許多過渡元素的離子(如Cu2+、Ag+等)和某些主族元素的離子或分子(如N3、H+等)都能形成配合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
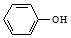 和
和 兩種物質的試劑是a(填字母).
兩種物質的試劑是a(填字母).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSeO4溶液和Na2SeO4溶液均顯堿性 | |
| B. | pH=3的H2SeO4和NaHSeO4溶液,后者水的電離程度大 | |
| C. | H2SeO4溶液中滴加少量氨水的離子方程式:H++NH3•H2O=NH4++H2O | |
| D. | Na2CO3溶液中加入少量H2SeO4的離子方程式為:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入稀鹽酸產生無色氣體,將氣體通入澄清石灰水中,溶液變渾濁,一定有 CO32- | |
| B. | 某溶液與濃 NaOH 溶液共熱,產生使濕潤藍色石蕊試紙變紅氣體,則原溶液中存在 NH4+ | |
| C. | 加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,一定有 SO 42- | |
| D. | 可用硝酸酸化的 AgNO3 溶液鑒別 Cl-、Br-、I- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2SO4發生氧化反應 | |
| B. | NaClO3作還原劑 | |
| C. | Na2SO4是還原產物 | |
| D. | 若反應中有1 mol電子轉移,則有1molClO2生成 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com