
 )是一種重要的化工原料和醫藥中間體,實驗室合成三苯甲醇的合成流程如圖1所示.裝置如圖2所示
)是一種重要的化工原料和醫藥中間體,實驗室合成三苯甲醇的合成流程如圖1所示.裝置如圖2所示 +H2O→
+H2O→ +M(OH)Br(堿式溴化鎂)
+M(OH)Br(堿式溴化鎂)| 物質 | 熔點 | 沸點 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有機溶劑 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有機溶劑 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多數有機溶劑 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常溫下為固體 | 能溶于水,溶于乙醇、醚等多數有機溶劑 | |

分析 (1)圖中玻璃儀器B的名稱是冷凝管,由于格氏試劑容易水解,B的作用是防止空氣中的水蒸氣進入裝置;
(2)裝置中滴加液體未用普通分液漏斗而用滴液漏斗的作用是平衡壓強,利用水浴加熱,受熱均勻,便于控制溫度;
(3)三苯甲醇粗產品中含有乙醚、溴苯、苯甲酸乙酯等有機物,三苯甲醇的沸點最高,所以先用蒸餾的方法除去有機雜質;堿式溴化鎂溶于水,不溶于有機溶劑,所以洗滌液選用水;檢查洗滌是否干凈,取少量最后一次洗滌液于試管中,用硝酸銀溶液檢驗是否含有溴離子;
(4)由2-OH~H2可計算出三苯甲醇的物質的量,再根據m=nM計算三苯甲醇的質量,進而計算產品中三苯甲醇的質量分數.
解答 解:(1)圖中玻璃儀器B的名稱是冷凝管,由于格氏試劑容易水解,B的作用是防止空氣中的水蒸氣進入裝置,避免格式試劑水解,
故答案為:冷凝管;防止空氣中的水蒸氣進入裝置,避免格氏試劑水解;
(2)裝置中滴加液體未用普通分液漏斗而用滴液漏斗的作用是平衡壓強,使漏斗內液體順利滴下;利用水浴加熱,受熱均勻,便于控制溫度;利用水浴加熱,受熱均勻,便于控制溫度;
故答案為:平衡壓強,使漏斗內液體順利滴下;水浴;
(3)三苯甲醇粗產品中含有乙醚、溴苯、苯甲酸乙酯等有機物,三苯甲醇的沸點最高,所以先用蒸餾或分餾的方法除去有機雜質;
由于堿式溴化鎂溶于水,不溶于有機溶劑,所以洗滌液選用水,故選a;
檢查洗滌是否干凈的一般步驟是:取少量最后一次洗滌液于試管中,滴加硝酸銀溶液,若無沉淀生成,則已洗滌干凈,反之則未洗滌干凈,
故答案為:蒸餾或分餾;a;取少量最后一次洗滌液于試管中,滴加硝酸銀溶液,若無沉淀生成,則已洗滌干凈,反之則未洗滌干凈;
(4)由2-OH~H2,可知三苯甲醇的物質的量是$\frac{0.1008L}{22.4L/mol}$×2=0.009mol,所以產品中三苯甲醇的質量是0.009mol×260g/mol=2.34g,則產品中三苯甲醇的質量分數=$\frac{2.34g}{2.60g}$×100%=90%,
故答案為:90%.
點評 本題考查有機物合成實驗、物質的分離與洗滌等基本操作、對實驗裝置的分析評價等,較好的考查學生對數據的應用、閱讀獲取信息的能力以及知識遷移應用,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 全對 | B. | 除①外全對 | C. | 除②外全對 | D. | 除③外全對 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向平衡體系中加入少量KCl固體或Fe(SCN)3固體,溶液紅色都變淺 | |
| B. | 向平衡體系中加入少量FeCl3固體或KSCN固體,溶液紅色加深 | |
| C. | 向平衡體系中加入水稀釋,平衡不移動,但溶液紅色變淺 | |
| D. | 該反應的離子方程式為:3KSCN+Fe3+═Fe(SCN)3(血紅色)+3K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2+2I-═2Cl-+I2 | B. | 穩定性:HCl>HI | ||
| C. | 酸性 HClO4>HIO4 | D. | 酸性 HClO3>HIO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
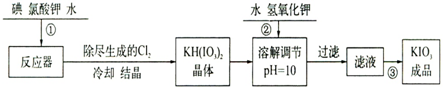
| 溫度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
| 操作步驟 | 實驗現象 |
| 取1g純凈的NaCl,甲3mL水配制溶液 | 溶液無變化 |
| 滴入5滴淀粉溶液和1mL0.1mol.L-1KI溶液,振蕩 | 溶液無變化 |
| 然后再滴入1滴1mol.L-1的H2SO4,從發振蕩 | 溶液變藍色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入蒸餾水 | B. | 加熱 | C. | 加入NaHSO4固體 | D. | 加入濃鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某物質的溶液中由水電離出的c(H+)=1×10-amol/L,若a>7時,則該溶液的pH一定為14-a | |
| B. | 某溶液中存在的離子有S2-、HS-、OH-、Na+、H+,則離子濃度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | 將0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等體積混合后溶液pH大于7,則反應后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | ①Na2CO3溶液②CH3COONa溶液③NaOH溶液,若3種溶液pH均為9,則它們物質的量濃度大小順序是①>②>③ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com