
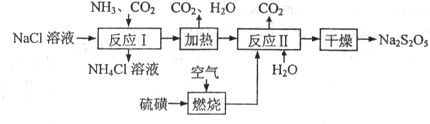
焦亞硫酸鈉(Na2S2O5)常用作食品漂白劑。其制備工藝流程如下:

已知:反應Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反應。
Na2S2O5+H2O等多步反應。
(1)實驗室制取氨氣的化學方程式: 。
(2)反應I的化學方程式為: 。
(3)“灼燒”時發生反應的化學方程式: 。
(4)已知Na2S2O5與稀硫酸反應放出SO2,其離子方程式為: 。
(5)副產品X的化學式是 。
(6)為了減少產品Na2S2O5中雜質含量,需控制反應Ⅱ中氣體與固體的物質的量之比約為 。檢驗產品中含有碳酸鈉雜質所需試劑是 (填編號)
①酸性高錳酸鉀 ②品紅溶液 ③澄清石灰水
④飽和碳酸氫鈉溶液 ⑤NaOH ⑥稀硫酸
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(3)2CuS+3O2  2CuO+2SO2
2CuO+2SO2
(4)S2O52-+2H+=2SO2↑+H2O
(5)CuSO4•5H2O
(6)2∶1 ①③⑥或①②③⑥ (每空2分)
【解析】
試題分析:(1)實驗室制取氨氣的藥品是NH4Cl和Ca(OH)2固體,在加熱條件下反應生成氨氣。(2)工藝流程可知,反應Ⅰ為生成NaHCO3,氯化鈉溶液通入氨氣、二氧化碳生成碳酸氫鈉與氯化銨。(3)有黑色固體可推知是CuO,說明流程中的CuS被空氣氧化成CuO和SO2,根據化合價升降配平即可。(4)Na2S2O5與稀硫酸反應生成SO2,反應中S元素的化合價未發生變化,同時生成硫酸鈉與水。(5)CuO與H2SO4生成CuSO4,將溶液CuSO4結晶可得到CuSO4·5H2O晶體。(6)反應Ⅱ中發生反應Na2CO3+H2O+2SO2=2NaHSO3+CO2↑,2NaHSO3 Na2S2O5+H2O故SO2與Na2CO3的物質的量之比接近2:1恰好完全反應;碳酸鈉的檢驗可將其轉化為CO2氣體檢驗,但SO2會干擾CO2的檢驗,所以應先除去SO2。因此檢驗產品中含有碳酸鈉雜質所需試劑是 ①③⑥或①②③⑥ 。
Na2S2O5+H2O故SO2與Na2CO3的物質的量之比接近2:1恰好完全反應;碳酸鈉的檢驗可將其轉化為CO2氣體檢驗,但SO2會干擾CO2的檢驗,所以應先除去SO2。因此檢驗產品中含有碳酸鈉雜質所需試劑是 ①③⑥或①②③⑥ 。
考點:考查無機化工生產工藝流程中的化學方程式的書寫和物質的檢驗。


科目:高中化學 來源: 題型:
| 加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2013-2014學年湖北省高三上學期期末考試理綜化學試卷(解析版) 題型:填空題
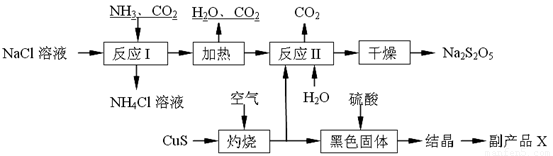
焦亞硫酸鈉(Na2S2O5)常用作食品漂白劑。其制備工藝流程如下:
已知:反應Ⅱ包含2NaHSO3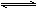 Na2S2O5+H2O等多步反應。
Na2S2O5+H2O等多步反應。
(1)實驗室制取氨氣的化學方程式: 。
(2)“灼燒”時發生反應的化學方程式: 。
(3)已知Na2S2O5與稀硫酸反應放出SO2,其離子方程式為: 。
(4)副產品X的化學式是: ;可循環利用的物質是:_________和_______。
(5)為了減少產品Na2S2O5中雜質含量,需控制反應Ⅱ中氣體與固體的物質的量之比約為 。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年廣東省高三第三次月考理綜化學試卷(解析版) 題型:填空題
焦亞硫酸鈉(Na2S2O5)常用作食品漂白劑。其制備工藝流程如下:
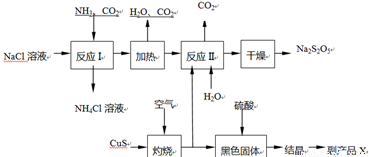
已知:反應Ⅱ包含2NaHSO3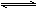 Na2S2O5+H2O等多步反應。
Na2S2O5+H2O等多步反應。
(1)實驗室制取氨氣的化學方程式: 。
(2)“灼燒”時發生反應的化學方程式: 。
(3)已知Na2S2O5與稀硫酸反應放出SO2,其離子方程式為: 。
(4)副產品X的化學式是: ;可循環利用的物質是:_____________。
(5)為了減少產品Na2S2O5中雜質含量,需控制反應Ⅱ中氣體與固體的物質的量之比約
為 。
(6)檢驗產品中含有碳酸鈉雜質所需試劑是 (填編號)
①酸性高錳酸鉀 ②品紅溶液 ③澄清石灰水 ④飽和碳酸氫鈉溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com