
【題目】LED產品的使用為城市增添色彩。下圖是氫氧燃料電池驅動LED發光的一種裝置示意圖。下列有關敘述正確的是
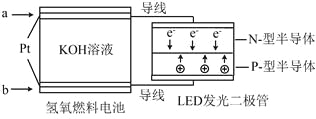
A.a處通入O2
B.b處為電池正極,發生了還原反應
C.通入O2的電極發生反應:O2+4e-+4H+ = 2H2O
D.該裝置將化學能最終轉化為電能
 一本好題口算題卡系列答案
一本好題口算題卡系列答案科目:高中化學 來源: 題型:
【題目】在兩個恒容的密閉容器中進行下列兩個可逆反應:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
現有下列狀態:①混合氣體平均相對分子質量不再改變
②恒溫時,氣體壓強不再改變 ③各氣體組成濃度相等
④反應體系中溫度保持不變 ⑤斷裂氫氧鍵速率是斷裂氫氫鍵速率的2倍 ⑥混合氣體密度不變 ⑦單位時間內,消耗水蒸氣質量與生成氫氣質量比為9∶1
其中能表明甲、乙容器中反應都達到平衡狀態的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳(Ni)有良好的耐高溫、耐腐蝕、防銹功能,在電池、催化劑方面有廣泛的應用。以硫化鎳礦(主要成分為NiS,另含少量CuS,FeS等雜質)為原料制取純鎳的工藝流程如下:
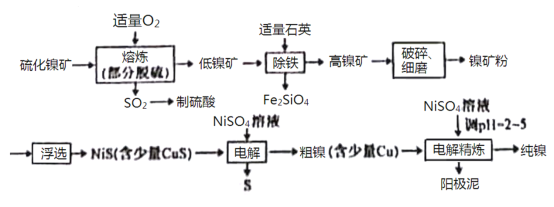
已知物質的還原性:Fe>Ni>H2>Cu。
回答下列問題:
(1)在“熔煉”過程中,二價鐵的化合價沒有發生改變,則雜質FeS與O2反應的化學方程式為___________________。
(2)高鎳礦破碎、細磨的作用是___________________。
(3)在焰色反應實驗中,可以用光潔無銹的鎳絲代替鉑絲蘸取化學試劑灼燒,原因是___________________。
(4)“除鐵”過程中,反應的化學反應方程式為___________________。
(5)“電解”制粗鎳過程中,陽極發生的主要電極反應為___________________。
(6)“電解精煉”過程中,需調節溶液的pH為2~5,原因是___________________。陽極泥的成分為___________________(寫名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對可逆反應4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列敘述正確的是
4NO(g)+6H2O(g),下列敘述正確的是
A.達到化學平衡時,4v正(O2) = 5v逆(NO)
B.若單位時間內生成x mol NO的同時,消耗x mol NH3,則反應達到平衡狀態
C.達到化學平衡時,若增加容器體積,則正反應速率減小,逆反應速率增大
D.化學反應速率關系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨催化分解既可防治氨氣污染,又能得到氫能源。回答下列問題:
(1)已知:①4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反應①的熱力學趨勢很大(平衡常數很大),其原因是________________。NH3分解的熱化學方程式為________________。
(2)在Co—Al催化劑體系中,壓強p0下氨氣以一定流速通過反應器,得到不同催化劑下NH3轉化率隨溫度變化的關系如圖所示。活化能最小的催化劑為________________:升高溫度,NH3的平衡轉化率增大,其原因是________________;溫度一定時,如果增大氣體流速,則b點對應的點可能________________(填“a”“c”“d”“e”或“f”)。
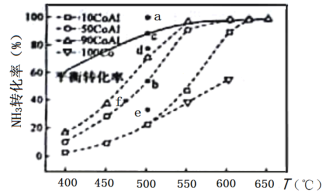
(3)溫度為T時,體積為1L的密閉容器中加入0.8molNH3和0.1molH2,30min達到平衡時,N2的體積分數為20%,則T時反應2NH3(g)N2(g)+3H2(g)的平衡常數K=________________mol2·L-2,NH3的分解率為________________,達到平衡后再加入0.8molNH3和0.1molH2,NH3的轉化率________________(填“增大”“不變”或“減小”)。
(4)將氨溶解于水也可消除氨氣的污染。常溫下,向10mL0.1mol·L-1氨水中逐滴加入相同濃度的CH3COOH溶液,在滴加過程中![]() =________________(填標號).
=________________(填標號).
A.始終堿小B.始終增大C.先減小后增大D.先增大后減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】瑞德西韋是一種核苷類似物,具有抗病毒活性,對新型冠狀病毒病例展現出較好的療效。其結構如圖所示:

回答下列問題:
(1)該結構基態P原子中,核外電子占據最高能層的符號是________________,占據該能層電子的電子云輪廓圖形狀為________________。
(2)瑞德西韋中位于第二周期元素的第一電離能從大到小的順序為________________,分子中氮原子的雜化類型有________________。
(3)苯酚(![]() )是合成瑞德西韋的原料之一,其熔點為43℃,苯酚的晶體類型是________________。苯酚與甲苯(
)是合成瑞德西韋的原料之一,其熔點為43℃,苯酚的晶體類型是________________。苯酚與甲苯(![]() )的相對分子質量相近,但苯酚的熔、沸點高于甲苯,原因是________________。
)的相對分子質量相近,但苯酚的熔、沸點高于甲苯,原因是________________。
(4)MgSO4是合成瑞德西韋的催化劑之一。MgSO4中,陰離子的空間構型為________________。
(5)磷酸也是合成瑞德西韋的原料之一。直鏈的多磷酸鹽則是-種復雜磷酸鹽,如:焦磷酸鈉、三磷酸鈉等。焦磷酸根離子、三磷酸根離子如圖所示:
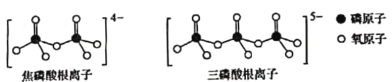
這類磷酸根離子的化學式可用通式表示為________________(用n代表P原子數)。
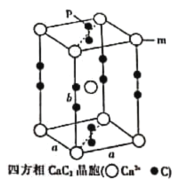
(6)合成瑞德西韋的原料之一的苯酚可通過如下途徑制得:電石(CaC2)→乙烯→苯→溴苯→苯酚。四方相碳化鈣(CaC2)晶體的晶跑結構如圖所示.其晶胞參數分別為apm、apm、bpm,四方相碳化鈣晶體的密度為![]() g·cm-3,[C≡C]2-中鍵長為cpm,阿伏加德羅常數的值為NA.則m位置的鈣離子與P位置的碳原子之間的距離為________________pm(用不含a的計算表達式表示)。
g·cm-3,[C≡C]2-中鍵長為cpm,阿伏加德羅常數的值為NA.則m位置的鈣離子與P位置的碳原子之間的距離為________________pm(用不含a的計算表達式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物M是某合成農藥的中間體,其結構為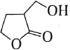 。下列有關的說法正確的是( )
。下列有關的說法正確的是( )
A.M能發生取代反應和加成反應
B.1molM與足量的NaOH溶液反應,最多可消耗2molNaOH
C.分子中有5個碳原子共平面
D.同時含有-CHO和-COOH結構的M的同分異構體有5種(不含立體異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《自然》雜志于2018年3月15日發布,中國留學生曹原用石墨烯實現了常溫超導。這一發現將在很多領域發生顛覆性的革命。鎵(Ga)、硒(Se)的單質及某些化合物如砷化鎵等都是常用的半導體材料,超導和半導體材料都廣泛應用于航空航天測控、光纖通訊等領域。請回答下列與碳、砷、鎵、硒有關的問題。
(1)基態硒原子的核外價層電子排布式為___,與硒同周期的p區元素中第一電離能大于硒的元素有___種,SeO3的空間構型是___。
(2)化合物[EMIM][AlCl4]具有很高的應用價值,EMIM+結構如圖所示。
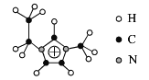
①EMIM+離子中各元素電負性由大到小的順序是___。
②EMIM+離子中碳原子的雜化軌道類型為___。
③大π鍵可用符號π![]() 表示,其中m、n分別代表參與形成大π鍵的原子數和電子數,則EMIM+離子中的大π鍵應表示___。
表示,其中m、n分別代表參與形成大π鍵的原子數和電子數,則EMIM+離子中的大π鍵應表示___。
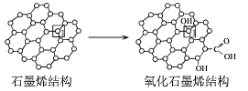
(3)石墨烯中部分碳原子被氧化后,轉化為氧化石墨烯如圖所示,轉化后1號C原子與相鄰C原子間鍵能變小,原因是___。
(4)GaAs為原子晶體,密度為ρgcm-3,其晶胞結構如圖所示,Ga和As的原子半徑分別為apm和bpm,GaAs晶胞中原子的體積占晶胞體積的百分率為A,則阿伏加德羅常數的值為NA=___。(用字母表示)

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com