
【題目】氨催化分解既可防治氨氣污染,又能得到氫能源。回答下列問題:
(1)已知:①4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反應(yīng)①的熱力學趨勢很大(平衡常數(shù)很大),其原因是________________。NH3分解的熱化學方程式為________________。
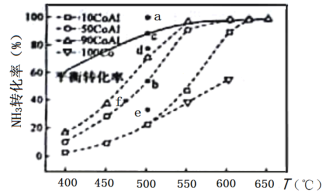
(2)在Co—Al催化劑體系中,壓強p0下氨氣以一定流速通過反應(yīng)器,得到不同催化劑下NH3轉(zhuǎn)化率隨溫度變化的關(guān)系如圖所示。活化能最小的催化劑為________________:升高溫度,NH3的平衡轉(zhuǎn)化率增大,其原因是________________;溫度一定時,如果增大氣體流速,則b點對應(yīng)的點可能________________(填“a”“c”“d”“e”或“f”)。
(3)溫度為T時,體積為1L的密閉容器中加入0.8molNH3和0.1molH2,30min達到平衡時,N2的體積分數(shù)為20%,則T時反應(yīng)2NH3(g)N2(g)+3H2(g)的平衡常數(shù)K=________________mol2·L-2,NH3的分解率為________________,達到平衡后再加入0.8molNH3和0.1molH2,NH3的轉(zhuǎn)化率________________(填“增大”“不變”或“減小”)。
(4)將氨溶解于水也可消除氨氣的污染。常溫下,向10mL0.1mol·L-1氨水中逐滴加入相同濃度的CH3COOH溶液,在滴加過程中![]() =________________(填標號).
=________________(填標號).
A.始終堿小B.始終增大C.先減小后增大D.先增大后減小
【答案】反應(yīng)①放出的熱量很大 2NH3(g)![]() N2(g)+3H2(g) △H=+92.1kJ/mol 90CoAl NH3分解反應(yīng)為吸熱反應(yīng),升高溫度,平衡向正反應(yīng)方向移動 e 7.5 75% 減小 B
N2(g)+3H2(g) △H=+92.1kJ/mol 90CoAl NH3分解反應(yīng)為吸熱反應(yīng),升高溫度,平衡向正反應(yīng)方向移動 e 7.5 75% 減小 B
【解析】
(1)根據(jù)蓋斯定律由![]() ×①-3(②+③)可得到目標熱化學方程式;
×①-3(②+③)可得到目標熱化學方程式;
(2)根據(jù)圖像中幾種催化劑對反應(yīng)歷程的影響進行分析,由外界條件對平衡移動的影響來分析判斷;
(3)根據(jù)題中提供的數(shù)據(jù)列出三段式,計算平衡常數(shù)和轉(zhuǎn)化率。
(4)根據(jù)二者混合后溶液里離子濃度的變化來分析。
(1)反應(yīng)①的ΔH1=-1266.6kJ·mol-1,放出的熱量很大,故熱力學趨勢很大;
反應(yīng):①4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1) ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1) ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g) ΔH3=+44.0kJ·mol-1
根據(jù)蓋斯定律,將方程式![]() ×①-3(②+③)得方程式2NH3(g)
×①-3(②+③)得方程式2NH3(g)![]() N2(g)+3H2(g) △H=
N2(g)+3H2(g) △H=![]() (-1266.6 kJ/mol)-3(-285.8+44) kJ/mol=+92.1 kJ/mol;
(-1266.6 kJ/mol)-3(-285.8+44) kJ/mol=+92.1 kJ/mol;
(2)由圖分析可知,90CoAl催化劑在較低溫度下就達到平衡狀態(tài),反應(yīng)速率最快,反應(yīng)的活化能最小;由2NH3(g)![]() N2(g)+3H2(g) △H=+92.1kJ/mol可知 NH3分解反應(yīng)為吸熱反應(yīng),升高溫度平衡向正反應(yīng)方向移動,NH3的轉(zhuǎn)化率增大;此反應(yīng)為氣體體積增大的反應(yīng),溫度一定時,增大氣體流速平衡逆向移動,氨氣轉(zhuǎn)化率減小,b點對應(yīng)的點可能為e點,答案為:90CoAl;NH3分解反應(yīng)為吸熱反應(yīng),升高溫度,平衡向正反應(yīng)方向移動;e;
N2(g)+3H2(g) △H=+92.1kJ/mol可知 NH3分解反應(yīng)為吸熱反應(yīng),升高溫度平衡向正反應(yīng)方向移動,NH3的轉(zhuǎn)化率增大;此反應(yīng)為氣體體積增大的反應(yīng),溫度一定時,增大氣體流速平衡逆向移動,氨氣轉(zhuǎn)化率減小,b點對應(yīng)的點可能為e點,答案為:90CoAl;NH3分解反應(yīng)為吸熱反應(yīng),升高溫度,平衡向正反應(yīng)方向移動;e;
(3)由題中數(shù)據(jù)可知,設(shè)達到平衡時氮氣的物質(zhì)的量為xmol,列三段式為:
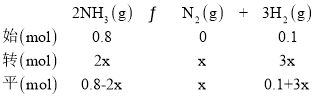
相同條件下氣體的物質(zhì)的量之比等于體積之比,所以達到平衡時N2的體積分數(shù)為:![]() =20%,解得x=0.3mol,因為容器體積為1L,氣體的物質(zhì)的量與物質(zhì)的量濃度數(shù)值相等,所以平衡常數(shù)K=
=20%,解得x=0.3mol,因為容器體積為1L,氣體的物質(zhì)的量與物質(zhì)的量濃度數(shù)值相等,所以平衡常數(shù)K=![]() =7.5,NH3的分解率為
=7.5,NH3的分解率為![]() 100%=75%;達到平衡后再加入0.8molNH3和0.1molH2,相當于增大壓強,反應(yīng)逆向移動,氨氣的轉(zhuǎn)化率減小,答案為:7.5;75%;減小;
100%=75%;達到平衡后再加入0.8molNH3和0.1molH2,相當于增大壓強,反應(yīng)逆向移動,氨氣的轉(zhuǎn)化率減小,答案為:7.5;75%;減小;
(4)常溫下,向10mL0.1mol·L-1氨水中逐滴加入相同濃度的CH3COOH溶液發(fā)生反應(yīng),CH3COOH電離出的H+消耗NH3·H2O電離出的OH-,c(OH-)減小,促進NH3·H2O的電離,銨根離子濃度增大,一水合氨濃度減小,因此在滴加CH3COOH溶液過程中![]() 比值始終增大,答案為B。
比值始終增大,答案為B。


 狀元坊全程突破導練測系列答案
狀元坊全程突破導練測系列答案科目:高中化學 來源: 題型:
【題目】甲醇被稱為2l世紀的新型燃料,工業(yè)上通過下列反應(yīng)Ⅰ和Ⅱ,用CH4和H2O為原料來制備甲醇。
(1)將1.0molCH4和2.0molH2O(g)通入容積為10L的反應(yīng)室,在一定條件下發(fā)生反應(yīng)Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g),CH4的轉(zhuǎn)化率與溫度、壓強的關(guān)系如圖:
CO(g)+3H2(g),CH4的轉(zhuǎn)化率與溫度、壓強的關(guān)系如圖:
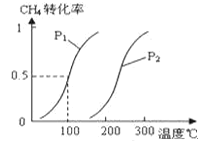
①已知100℃時達到平衡所需的時間為5min,則用H2表示的平均反應(yīng)速率為______。
②在其它條件不變的情況下升高溫度,化學平衡常數(shù)將_______(填“增大”“減小”或“不變”)。
③圖中的P1_____P2(填“<”、“>”或“=”),100℃時平衡常數(shù)為________。
④保持反應(yīng)體系為100℃,5min后再向容器中充入H2O、H2各0.5mol,化學平衡將向_____移動(填“向左”“向右”或“不”)。
(2)在壓強為0.1MPa條件下,將amolCO與3amol H2的混合氣體在催化劑作用下能自發(fā)發(fā)生反應(yīng)Ⅱ:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①該反應(yīng)的△H_____0,△S_____0(填“<”、“>”或“=”)。
②若容器容積不變,下列措施可以提高CO轉(zhuǎn)化率的是______。
A.升高溫度
B.將CH3OH(g)從體系中分離出來
C.充入He,使體系總壓強增大
D.再充入1molCO和3molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現(xiàn)有金屬單質(zhì)A、B、C和氣體甲、乙、丙及物質(zhì)D、E、F、G、H,它們之間能發(fā)生如下反應(yīng)(圖中有些反應(yīng)的產(chǎn)物和反應(yīng)的條件沒有全部標出)。
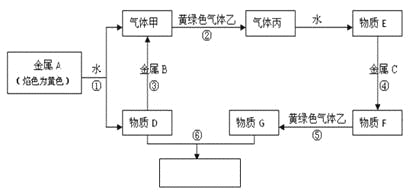
請根據(jù)以上信息回答下列問題:
(1)寫出下列物質(zhì)的化學式
A、______B、______C、________乙__________
(2)寫出下列反應(yīng)化學方程式:
反應(yīng)①___________________________________
反應(yīng)③___________________________________
(3)寫出下列反應(yīng)離子方程式:
反應(yīng)④___________________________________
反應(yīng)⑥___________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中進行如下反應(yīng): X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始濃度分別為0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定條件下,當反應(yīng)達到平衡時,各物質(zhì)的濃度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始濃度分別為0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定條件下,當反應(yīng)達到平衡時,各物質(zhì)的濃度有可能是 ( )
A.Z 為 0.3mol/LB.Y2 為 0.4mol/LC.X2 為 0.2mol/LD.Z 為 0.4mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LED產(chǎn)品的使用為城市增添色彩。下圖是氫氧燃料電池驅(qū)動LED發(fā)光的一種裝置示意圖。下列有關(guān)敘述正確的是
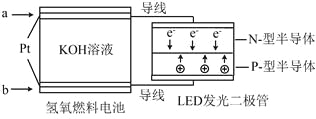
A.a處通入O2
B.b處為電池正極,發(fā)生了還原反應(yīng)
C.通入O2的電極發(fā)生反應(yīng):O2+4e-+4H+ = 2H2O
D.該裝置將化學能最終轉(zhuǎn)化為電能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應(yīng)A2(g)+B2(g)===2AB(g)的能量變化如圖所示。下列有關(guān)敘述正確的是
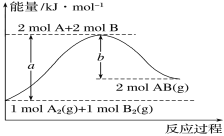
A.每生成2molAB(g)吸收bkJ熱量
B.斷裂1molA—A鍵和1molB—B鍵,放出akJ能量
C.該反應(yīng)中反應(yīng)物的總能量高于生成物的總能量
D.反應(yīng)熱ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖裝置測定中和熱的實驗步驟如下:

①用量筒量取50 mL0.25mol/L硫酸倒入小燒杯中,測出硫酸溫度;
②用另一量筒量取50 mL0.55mol/L NaOH溶液,并用另一溫度計測出其溫度;
③將NaOH溶液倒入小燒杯中,設(shè)法使之混合均勻,測出混合液最高溫度。
回答下列問題:
(1)大小燒杯中填充泡沫塑料的作用是____。
(2)倒入NaOH溶液的正確操作是___(從下列選出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒緩慢倒入
(3)使硫酸與NaOH溶液混合均勻的正確操作是____。
(4)實驗數(shù)據(jù)如下表:
①請?zhí)顚懴卤碇械目瞻祝?/span>
溫度 實驗次數(shù) | 起始溫度t1℃ | 終止溫度t2/℃ | 溫度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似認為0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比熱容c=4.18 J/(g·℃)。則中和熱ΔH=____( 取小數(shù)點后一位)。
③上述實驗數(shù)值結(jié)果與57.3 kJ/mol有偏差,產(chǎn)生偏差的原因可能是(填字母)____。
a.實驗裝置保溫、隔熱效果差
b.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度
c.分多次把NaOH溶液倒入盛有硫酸的小燒杯中
d.量取NaOH溶液的體積時仰視讀數(shù)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室還可以利用高錳酸鉀制氯氣,其原理為:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O,若有15.8g KMnO4做氧化劑,試計算參加反應(yīng)鹽酸的物質(zhì)的量和被氧化的鹽酸的質(zhì)量____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關(guān)實驗裝置、操作中不能實現(xiàn)相應(yīng)實驗?zāi)康牡氖?/span> ( )
A | B | C | D | |
裝 置 |
|
|
|
|
目的 | 證明AlCl3是共價化合物 | 證明在NaOH的乙醇溶液中加熱溴乙烷時有乙烯生成 | 證明氯氣氧化性強于I2 | 比較Ksp(AgCl)、Ksp(AgBr)的相對大小 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com